
【题目】图为周期表的一小部分,A、B、C、D、E 的位置关系如图所示。其中 B 元素最高化合价是最低化合价绝对值的 3 倍,它的最高价氧化物中含氧 60%。下列说法正确的( )
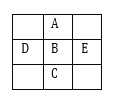
A.D、B、E 三种元素的非金属性逐渐减小
B.B 元素最高价氧化物对应的水化物是强酸
C.A 元素是空气中含量最多的元素
D.气态氢化物的稳定性顺序: D > B > E
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
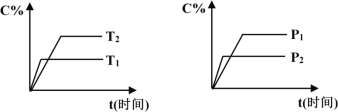
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是______。
②原子半径r(Cl)_____r(Mg),离子半径r(O2-)______r(Mg2+)(填“>”、“<”或“=”)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____晶体,Ni与CO之间的化学键称为__________,提供孤对电子的成键原子是_________。(填元素符号)
(5)一种钛镍合金的立方晶胞结构如图所示:
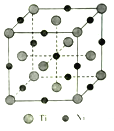
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]有机物E是医药合成中间体。其合成路线如下:

(1)![]() 的官能团名称为____________。
的官能团名称为____________。
(2)已知![]() 的系统命名为2-丙酮酸,则A的名称是 。
的系统命名为2-丙酮酸,则A的名称是 。
(3)D为二元酯,则B→D的化学方程式为 。
(4)D→E的反应历程如下:
![]()
其中属于取代反应的是_________(填序号)![]() 中能与稀NaOH溶液反应的官能团是 。检验该官能团的方法是_________。
中能与稀NaOH溶液反应的官能团是 。检验该官能团的方法是_________。
(5)写出满足下列条件的D的所有同分异构体的结构简式 。
a.核磁共振氢谱有4组峰
b.常温下能与NaHCO3按1:2反应并释放出气体
(6)由化合物A经过两步便可以合成环境友好型高聚物聚3-羟基丁酸酯![]() 请写出反应合成线路______________。(无机试剂任用)
请写出反应合成线路______________。(无机试剂任用)
合成线路示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学化学中常用的强氧化剂。某化学研究小组用软锰矿(主要成分为MnO2另含有少量铁、铝等金属的化合物)吸收燃煤尾气中的SO2,并制取MnO2和K2SO4,而后又用MnO2 制取KMnO4。设计生产流程如下:请回答下列问题:
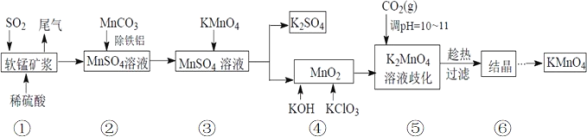 20℃时,相关物质的溶解度数据见下表:
20℃时,相关物质的溶解度数据见下表:
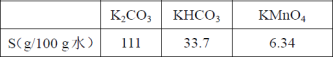
(1)若将SO2气体通入下列溶液中,溶液不会褪色的是___。
A.紫色石蕊试液 B.品红溶液 C.新制氯水 D.酸性高锰酸钾溶液
(2)用 MnCO3 除去液体中的 Fe3+时发生的离子方程式__________。
(3)步骤④中应在______中熔化;
A.瓷坩埚 B.铁坩埚 C.石英坩埚 D.蒸发皿
当溶液调 pH达10~11时,停止通入 CO2。若 CO2过多,会造成的后果是:______。
(4)在此生产流程中,可循环使用的物质是(填名称)________。
步骤⑤中发生反应的化学方程式为_________;
步骤⑤之后,趁热过滤的理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH是制备有机合成的重要还原剂LiAlH4的反应物,氢化锂遇水蒸气剧烈反应。某小组设计如图装置制备LiH。
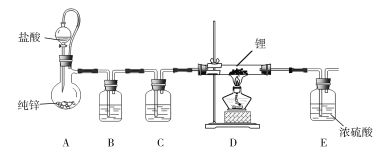
下列说法正确的是
A. 装置B、C依次盛装浓硫酸、饱和食盐水B. 装置A中加入硫酸铜越多,反应速率越大
C. 装置E用于吸收尾气,避免污染环境D. 实验中,先通入H2,后点燃酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
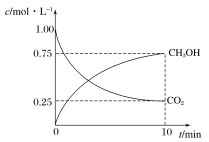
(1)该反应的平衡常数K表达式为________。
(2)0~10min时间内,该反应的平均反应速率v(H2O)=_______,H2的转化率为_______。
(3)下列叙述中,能说明反应已达到化学平衡状态的是________(填字母)。
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1∶3∶1∶1
B.v正(CO2)∶v逆(H2)=1∶3
C.平衡常数K保持不变
D.混合气体的平均相对分子质量保持不变
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1452.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
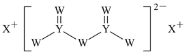
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 0.1 mol·L-1的醋酸加水稀释,c(CH3COOH)/c(CH3COO—)减小
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
C. 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少
D. 常温下pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com