
【题目】用如图所示装置进行下列实验,将分液漏斗中溶液X加入圆底烧瓶中与Y反应,对试管B中现象描述不正确的是
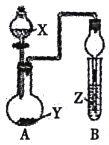
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 70%H2SO4 | Na2SO3溶液 | H2S溶液 | 产生浑浊 |
B | 浓氨水 | CaO | 酚酞试剂 | 溶液变红 |
C | 盐酸 | 大理石 | Na2SiO3溶液 | 出现白色沉淀 |
D | 浓盐酸 | MnO2 | NaOH溶液 | 黄绿色气体被吸收 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存.
(1)一定温度下,向1L 0.1molL﹣1CH3COOH溶液中加入0.1mol CH3COONa固体,溶液中 ![]() (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 .
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 .
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:回答下列问题: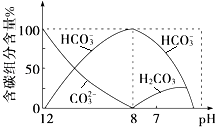
①在同一溶液中,H2CO3、HCO ![]() 、CO
、CO ![]() (填“能”或“不能”)大量共存;
(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、 , 溶液中含量最多的三种微粒的物质的量浓度的大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3在空气中易潮解,加热易升华。请回答下列问题:
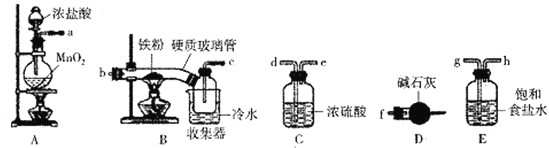
(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
实验步骤 | 实验现象 | 实验结论 |
①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是 ( )
A. Na2CO3是弱碱 B. Na2CO3是可溶性盐
C. Na2CO3是钠盐 D. Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-Cu-空气燃料电池的原理示意如图,电池通入空气腐蚀铜电极而产生正极反应物Cu2O。下列有关说法正确的是
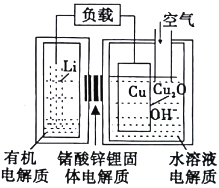
A. 电池工作时,正极上有金属锂析出
B. 电池工作时,负极区溶液中c(OH-)增大
C. 电池放电过程中的总反应为:2Cu+2Li++2OH-=2Li+Cu2O+H2O
D. 停止通入空气一段时间,电池将停止放电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.76g铜镁合金完全溶解于一定浓度的硝酸中,得到NO和NO2标准状况下896mL的混合气体,向反应后的溶液中加入lmol/L的NaOH溶液,当金属离子全部沉淀时,得到3.12g沉淀。下列说法不正确的是
A. 合金中铜镁物质的最之比为1:1
B. 产生的NO和NO2的体积之比为1:1
C. 得到3.12g沉淀时,加入NnOH溶液体积一定是80mL
D. 1.76g该合金与足量盐酸反应,可生成标准状况下448mL气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是( )
A.电解质AgNO3溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标况)
C.转移1.204×1022个电子
D.反应中有0.01mol的Ag被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com