
���� ��1����pH��ֽ���0.10mol/L�Ĵ�����ҺpH=4��˵�����Ჿ�ֵ��룻
��2�������Ϊ���ᣬ���Ũ��ʱ��������Һ��c��H+����С����Ӧ������
��3������ʯ����Һ���Ժ�ɫ���ټ�������ƾ��壬��ɫ��dz��˵����Һ��c��OH-���仯��
��4������Ϊ������ʣ�c��H+����ͬʱ������Ũ�Ƚϴ�
��5�������Ϊ���ᣬ��ϡ�ʹٽ����룮
��� �⣺��1��0.1mol•L-1��һԪǿ���pH=1��0.10mol/L�Ĵ�����ҺpH=4��˵������û����ȫ���룬���֤��Ϊ���ᣬ
�ʴ�Ϊ����ȷ��
��2�������Ϊ���ᣬ���Ũ��ʱ��������Һ��c��H+����С����Ӧ�������ɹ۲쵽п�����ᷴӦ�����������ٶȿ죬
�ʴ�Ϊ��п�����ᷴӦ�����������ٶȿ죻
��3������ʯ����Һ���Ժ�ɫ���ټ�������ƾ��壬��ɫ��dz��˵����Һ��c��OH-���仯��˵������ƽ���ƶ���ԭ���Ǵ�����Һ���ֵ��룬��������ƣ����������Ũ������ƽ�������ƶ���c��H+����С��
�ʴ�Ϊ��������Һ���ֵ��룬��������ƣ������Ũ������ƽ�������ƶ���c��H+����С��
��4���ֱ�ȡ��10mL c��H+��=10-3mol/L����ʹ��ᣬȻ��ֱ����������ͬ��п���������Ϊ���ᣬ��Ũ�Ƚϴ���п��ַ�Ӧʱ���������������϶࣬����ϴ�
�ʴ�Ϊ����
��5�������Ϊ���ᣬ��ϡ�ʹٽ����룬c��H+��=10-3mol/L�Ĵ���ϡ�͵�ԭ����100����ϡ�ͺ�����c��H+����10-5mol/L��
�ʴ�Ϊ������
���� ���⿼����������ʵĵ���ƽ�⼰��Ӱ�죬��Ŀ�Ѷ��еȣ������������ȷ���������������ʵĸ�����߱�������ǿ�������ȫ���롢������ʲ��ֵ��룬���������ѧ���ķ���������ʵ�������Ŀ��飮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ�����μ��ⶼ�ֽܷ� | |
| B�� | AgBr����ֽ⣬�������й���� | |
| C�� | AgI�������˹����� | |
| D�� | AgCl��AgBr��AgI�Ȳ�����ˮҲ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ʼ���� | ������ȫ | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� | HF | Ka=6.8��10-4 mol•L-1 |
| �� | CH3COOH | Ka=1.7��10-5 mol•L-1 |
| �� | HCN | Ka=6.2��10-10 mol•L-1 |
| �� | H2CO3 | Ka1=4.4��10-7 mol•L-1 Ka2=4.7��10-11 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH=4�Ĵ�����Һϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ����� | |
| B�� | �к�pH���������ͬ������ʹ�����Һ������NaOH�����ʵ�����ͬ | |
| C�� | ��֪pOH=-lg[c��OH-��]����֪�����������˵�ѪҺpH=7.35����ѪҺ��pOHΪ6.65 | |
| D�� | KCN��Һ���о綾HCN�ӷ�������Ϊ�˼���HCN�����ɣ���ѷ����Ǽ���KOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
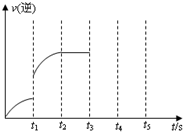 һ���¶��������Ϊ5L���ܱ������з������淴Ӧ��
һ���¶��������Ϊ5L���ܱ������з������淴Ӧ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com