
【题目】钨(74W)是熔点最高的金属,是重要的战略物资。自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。②上述流程中,除最后一步外,其余步骤钨的化合价未变。③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸中钨元素的化合价为_________,写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___________________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_______________________________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则T1________T2(填“>”或“<”)。
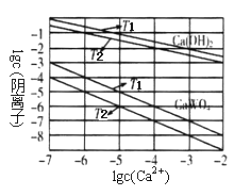
将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_________________,T2时该反应的平衡常数为_________________。
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2。该阳极反应式为_________________。
【答案】+62MnWO4+O2+4NaOH![]() 2MnO2+2Na2WO4+2H2OHAsO32-+H2O2=HAsO42-+H2O<WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-1×103WC+6H2O-10e-=H2WO4↓+CO2↑+10H+
2MnO2+2Na2WO4+2H2OHAsO32-+H2O2=HAsO42-+H2O<WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-1×103WC+6H2O-10e-=H2WO4↓+CO2↑+10H+
【解析】
由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,钨酸锰和氢氧化钠反应生成钨酸钠和氢氧化锰,水浸时,氧化铁和氢氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液含钨酸钠,滤渣I的主要成份是Fe2O3、MnO2,钨酸钠和浓硫酸反应生成钨酸和硫酸钠;加入过氧化氢,氧化+5价的钨为+6价,加入氯化镁,生成难溶于水的MgSiO3、MgHAsO4、MgHPO4,过滤,滤液为钨酸钠,酸化,加热分解产生三氧化钨和水,用还原剂还原三氧化钨生成钨.
(1)根据在化合物中正负化合价代数和为零,确定钨酸盐(FeWO4、MnWO4)中钨元素的化合价;根据流程图的提示锰的钨酸盐和氢氧化钠和氧气反应生成MnO2等物质;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,据此书写离子反应方程式;
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。由图读出溶解度和温度的关系,确定温度的高低;将钨酸钠溶液加入石灰乳得到钨酸钙沉淀和氢氧根离子,据此书写离子反应式,反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积的比,据此计算T2时该反应的平衡常数;
(4)电解时阴极得到电子,由于电解质溶液是酸性介质,所以阴极是氢离子放电生成氢气,碳化钨做阳极,碳化钨(WC)失去电子生成H2WO4.
(1)钨酸盐FeWO4为钨酸亚铁,钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,设钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+x,因化合物中正负化合价代数和为零,则+2+x+(-2)×4=0,解得x=+6,黑钨矿的主要成分是铁和锰的钨酸盐,根据流程图的提示,黑钨矿在空气中熔融生成WO42-、MnO2,、Fe2O3等,转化中生成MnO2的化学反应方程式为2MnWO4+O2+4NaOH![]() 2MnO2+2Na2WO4+2H2O;
2MnO2+2Na2WO4+2H2O;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。从图看出当钙离子浓度相同时,T2时阴离子浓度小,所对应温度高,T1<T2;将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-,T2时,C(OH-)=10-2mol·L-1,c(WO42-)=10-7mol·L-1,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积的比,即K=C2(OH-)C(WO42-)=(10-2)2/10-7=1×103;
(4)电解时,阴极是氢离子放电生成氢气,电极反应式是2H++2e-=H2↑,阳极是碳化钨失去电子,发生氧化反应:WC+6H2O-10e-=H2WO4+CO2↑+10H+,


科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分別取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液変红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分別取2mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______(填离子符号);实验①和实验③说明:在I-过量的情况下,溶液中仍含有_____(填离子符号);由此可以证明该氧化还原反应为___________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________。生成沉淀的原因是______________(用平衡移动原理解释)。
(6)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液通入标准状况下112mLCl2,恰好将Fe2+完全氧化,则x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为血红色,则下列叙述不正确的是 ( )
A. 原溶液中的Br-不一定被氧化
B. 通入氯气之后原溶液中的Fe2+一定被氧化
C. 不能确定通入氯气之后的溶液中是否存在Fe2+
D. 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
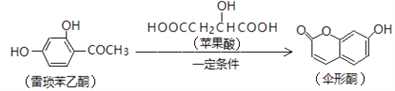
下列说法中正确的是
A. 1mol雷琐苯乙酮最多能与3mol Br2发生取代反应
B. 苹果酸能形成一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硫元素表现出还原性的是( )
A. 稀硫酸与锌粒反应 B. 亚硫酸与氧气反应
C. 浓硫酸与炭反应 D. Na2SO3固体与浓H2SO4反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 铵态氮肥不能与碱性肥料混合施用
B. 液氨可用作致冷剂
C. O2、H2S、SO2、H2均能用浓硫酸干燥,且常温能共存
D. 过量的SO2可使紫色石蕊溶液变红,但不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_________mol·L-1(保留2位有效数字)
(2)某同学取100 mL 该“84消毒液”,按规定标准稀释后用于消毒,稀释后的溶液中:c(Na+)=__________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是__________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(4)如上面第(3)小题A选项所示,除了应该使用的仪器外,还需要的玻璃仪器是______________。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1的浓硫酸配制2000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol·L-1。
②需用浓硫酸的体积为__________mL。
(6)测定“84消毒液”中次氯酸钠含量的主要步骤:
a.取5.00mL“84消毒液”经稀释等步骤最后定容于250mL容量瓶中;
b.取稀释后的溶液25.00mL于锥形瓶中,加入足量硫酸酸化的KI溶液,在阴凉处静置5分钟;
c.加入5~10滴0.5%的淀粉溶液,溶液变蓝色,再用c mol·L-1Na2S2O3溶液滴定,当消耗的Na2S2O3溶液为VmL时,溶液的蓝色恰好退去,且半分钟内蓝色不再恢复。则“84消毒液”中NaClO的浓度为__________g·L-1。(用c、V表示)
(已知:2KI + H2SO4 + NaClO = I2 + K2SO4 + NaCl + H2O;I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com