
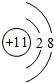 .
.分析 X、Y、Z三种元素,均位于元素周期表中的第三周期,X元素原子核外K层、L层电子数之和比L层、M层电子数之和多1个电子,则X最外层电子数是1,为Na元素;
Y元素的-2价阴离子与氩原子的电子层结构相同,则Y是S元素;
Z元素的原子在此三种元素中原子半径最小,则Z为Cl元素;
(1)X的简单阳离子是钠离子,其原子核外有10个电子;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,其最高价与其族序数相等;
(3)元素的非金属性越强,其氢化物的稳定性越强,其最低负价=族序数-8;
(4)元素的金属性越强,其简单阴离子的还原性越弱.
解答 解:X、Y、Z三种元素,均位于元素周期表中的第三周期,X元素原子核外K层、L层电子数之和比L层、M层电子数之和多1个电子,则X最外层电子数是1,为Na元素;
Y元素的-2价阴离子与氩原子的电子层结构相同,则Y是S元素;
Z元素的原子在此三种元素中原子半径最小,则Z为Cl元素;
(1)X的简单阳离子是钠离子,其原子核外有10个电子,钠离子结构示意图为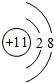 ,故答案为:
,故答案为: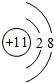 ;
;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,其最高价与其族序数相等,非金属性Cl>S,则其最高价氧化物的水化物酸性增强顺序是H2SO4、HClO4,故答案为:H2SO4、HClO4;
(3)元素的非金属性越强,其氢化物的稳定性越强,其最低负价=族序数-8,非金属性Cl>S,则其氢化物稳定性强弱顺序是HCl、H2S,故答案为:HCl、H2S;
(4)元素的金属性越强,其简单阴离子的还原性越弱,非金属性Cl>S,则其简单阴离子还原性强弱关系为S2->Cl-,故答案为:S2->Cl-.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及非金属性强弱判断,正确判断元素是解本题关键,知道非金属性强弱与其氢化物稳定性、最高价氧化物的水化物酸性、简单阴离子还原性关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ca2+、HCO3-、NH4+、AlO2- | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Na+、NH4+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
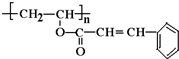
 ;
; 、
、 ,且苯环上有两个对位取代基的结构简式是
,且苯环上有两个对位取代基的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
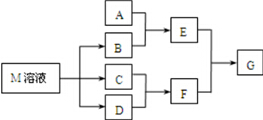 某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):
某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):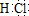 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
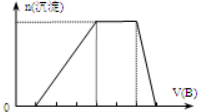
 在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示:
在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L NO2含氧原子数为NA | |
| B. | 标准状况下,14g CO所含质子数为7NA | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 25℃,101KPa条件下,1.4g N2的体积为1.12L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com