
(18分)在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:

(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3产率的有 (填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.吸收NH3 G.通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。
(1) AB (2) (3)BCFG
(4) AC段,反应开始时温度升高,反应速率增大,反应向正反应方向进行,生成NH3;CE段,已经达到平衡,升高温度使平衡向逆反应方向移动NH3%变小
【解析】
试题分析:(1)N2、H2合成NH3反应是放热的,升高温度平衡逆向移动,NH3的百分含量降低,所以升高温度NH3的百分含量升高,说明反应未答平衡。因此AB两点是未达到平衡的点。
(2) N2 + 3H2 = 2NH3
起始 1mol 3mol 0
反应 xmol 3xmol 2xmol
T3时 (1-x)mol (3-3x)mol 2xmol
根据T3时体系压强为原来的7/8,则有 ,所以x=0.25mol。
,所以x=0.25mol。
所以生成0.5molNH3放热23.1 kJ,则热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ/mol。
(3)根据N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ/mol可知,增大压强,降低温度,吸收氨气,通入氮气,都可以增加氨气的产率。
(4)从AC段可以看出平衡正向移动,说明反应没有达到平衡,所以升高温度扔正向移动,CE段可以看出平衡逆向移动,说明反应达到平衡,升高温度平衡逆向移动。
考点:化学平衡与化学反应热
点评:本题综合性强,主要考查学生分析问题的能力,是高考的热点习题。


科目:高中化学 来源:2012-2013学年山东省济宁市泗水一中高二12月质量检测化学试卷(带解析) 题型:填空题
(18分)在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3产率的有 (填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林省长春二中高二上学期期末考试化学试卷(带解析) 题型:填空题
(18分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)? ?CH3OH(g)。
?CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=__________________。
②下列各项中,不能够说明该反应已达到平衡的是________(填序号)。
A、恒温、恒容条件下,容器内的压强不发生变化
B、一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C、一定条件下,CO、H2和CH3OH的浓度保持不变
D、一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是________。
A、升高温度
B、将CH3OH(g)从体系中分离
C、使用合适的催化剂
D、充入He,使体系总压强增大
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。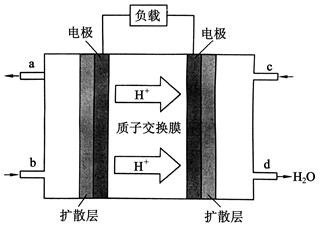
①该电池工作时,b口通入的物质为______________,c口通入的物质为_____________。
②该电池正极的电极反应式为:________。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有_____________NA个电子转移。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高二上学期期末考试化学试卷(解析版) 题型:填空题
(18分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)? ?CH3OH(g)。
?CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=__________________。
②下列各项中,不能够说明该反应已达到平衡的是________(填序号)。
A、恒温、恒容条件下,容器内的压强不发生变化
B、一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C、一定条件下,CO、H2和CH3OH的浓度保持不变
D、一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是________。
A、升高温度
B、将CH3OH(g)从体系中分离
C、使用合适的催化剂
D、充入He,使体系总压强增大
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为______________,c口通入的物质为_____________。
②该电池正极的电极反应式为:________。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有_____________NA个电子转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com