
已知:2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ/mol。某温度下,向一体积为2L的密闭容器中充入0.2molSO2和0.1molO2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是
2SO3(g) △H=-196 kJ/mol。某温度下,向一体积为2L的密闭容器中充入0.2molSO2和0.1molO2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是
A.5min内用O2表示的反应速率为0.12mol/(L·min)
B.加入催化剂,可使该反应的化学反应速率加快,△H变小
C.SO2的平衡浓度为0.12mol/L
D.达到平衡时,若增大容器的体积,则该反应的化学反应速率减慢
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源:2017届河北省沧州市高三上周测化学试卷(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。下列正确的是

A.由TiO2制得1mol金属Ti,理论上外电路转移2NA电子
B.阳极的电极反应式为:C+2O2--4e-═CO2↑
C.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
D.在制备金属钛前后,整套装置中CaO的总量减少
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二下期末化学试卷(解析版) 题型:选择题
某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构)( )
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学测化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
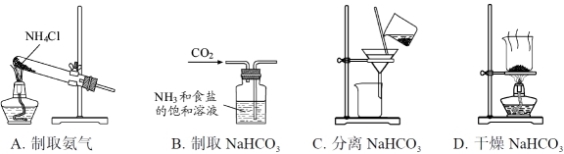
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:推断题
已知A是石油裂解产生的一种气态烃,完全燃烧时产生的水和二氧化碳的物质的量之比为1:1。B和D是生活中常见的两种有机物。它们之间的相互转化关系如图所示。(反应条件未写出)
又知2CH3CHO+O2 2CH3COOH。请回答下列问题;
2CH3COOH。请回答下列问题;
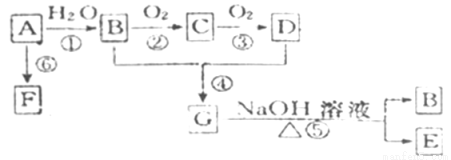
(1)写出A的电子式 。
(2)B、D分子内含有的官能团分别是 、 (填名称)。
(3)写出下列反应的反应类型:② ④ 。
(4)写出下列反应的化学方程式:
① ;② ;④ ;⑤ 。
(5)燃烧92g的乙醇需要标准状况下的氧气体积为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
电池是人类生产和生活中的重要能量来源,各式各样电池的发明时化学对人类的一项重大贡献,下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
下列关于反应中,前者属于取代反应,后者属于加成反应的是
A.光照甲烷和氯气的混合物;乙烯使酸性高锰酸钾褪色
B.乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷
C.苯滴入浓硝酸和浓硫酸的混合液中并水浴加热;乙烯与水蒸气在一定条件下反应生成乙醇
D.在苯中滴入溴水,溴水褪色;乙烯使溴水褪色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师大附中高二上第一次月考化学卷(解析版) 题型:选择题
已知分解1mol H2O2放出热量98kJ,在含少量I﹣的溶液中,H2O2分解的机理为:
H2O2+I﹣→H2O+IO﹣ 慢
H2O2+IO﹣→H2O+O2+I﹣ 快
下列有关该反应的说法正确的是( )
A.反应速率与I﹣的浓度有关 B.IO﹣也是该反应的催化剂
C.反应活化能等于98kJ•mol﹣1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周练化学试卷(解析版) 题型:实验题
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:

①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com