
(共7分)(1)在热的稀硫酸溶液中溶解了11.4gFeSO4.当加入50mL0.5mol/LKNO3
溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出.
□ FeSO4+□KNO3+□H2SO4→□K2SO4+□Fe2(SO4)3+□NXOy+□H2O
①推算出x=________,y=________.
②配平该化学方程式(系数填写在上式方框内)
③反应中氧化剂为________.
④用短线和箭头标出电子转移的方向和总数.
科目:高中化学 来源: 题型:阅读理解

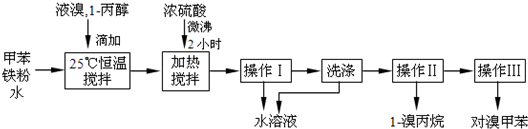
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | |
| 沸点℃ | 110.8 | 97.2 | 71 | |
| 物质 | 对溴甲苯 | 邻溴甲苯 | ||
| 沸点℃ | 184.3 | 181.7 | ||
查看答案和解析>>
科目:高中化学 来源:2012届上海市松江区高三上学期期末(1月)考试化学试卷(带解析) 题型:填空题
(本题共8分)
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。根据题意回答:
1.31g白磷与足量的氧气完全燃烧生成P2O5固体,释放出745.5 kJ的热量,请写出白磷燃烧的热化学反应方程式: ;
2.完成并配平白磷和氯酸溶液反应的化学方程式:
P4 + HClO3 + → HCl + H3PO4
3.白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O → 20Cu3P + 24H3PO4 + 60H2SO4
该反应的氧化产物是 ,若有1.1 mol P4反应,则有 mol电子转移。
4.磷的一种化合物叫亚磷酸(H3PO3)。已知:⑴0.1 mol/L H3PO3溶液的pH = 1.7;⑵H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;⑶H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是 .
| A.②④⑥ | B.②③⑥ | C.①④⑤ | D.②③⑤ |
查看答案和解析>>
科目:高中化学 来源:2010年湖北襄樊四校高三上学期期中联考化学卷 题型:填空题
(共7分)(1)在热的稀硫酸溶液中溶解了11.4gFeSO4.当加入50mL0.5mol/LKNO3
溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出.
□ FeSO4+□KNO3+□H2SO4→□K2SO4+□Fe2(SO4)3+□NXOy+□H2O
①推算出x=________,y=________.
②配平该化学方程式(系数填写在上式方框内)
③反应中氧化剂为________.
④用短线和箭头标出电子转移的方向和总数.
查看答案和解析>>
科目:高中化学 来源: 题型:
(共7分)(1)在热的稀硫酸溶液中溶解了11.4gFeSO4.当加入50mL0.5mol/LKNO3
溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出.
FeSO4+□KNO3+□H2SO4→□K2SO4+□Fe2(SO4)3+□NXOy+□H2O
①推算出x=________,y=________.
②配平该化学方程式(系数填写在上式方框内)
③反应中氧化剂为________.
④用短线和箭头标出电子转移的方向和总数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com