
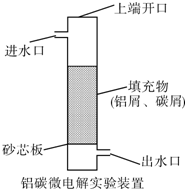


科目:高中化学 来源: 题型:
| A、稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ |
| B、实验室制二氧化碳:CaCO3+2H+═CO2↑+H2O+Ca2+ |
| C、氯气与水反应:Cl2+H2O═Cl-+ClO-+2H+ |
| D、AlCl3溶液与过量氨水反应:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中逐滴加入稀盐酸 | 试管里出现白色沉淀 | 元素非金属性:Cl>Si |
| B | 向某溶中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁片遇浓硫酸会钝化,浓硫酸表现强氧化性 |
| D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
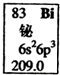
| A、Bi元素的质量数是209 |
| B、Bi元素的相对原子质量是83 |
| C、Bi基态原子6p轨道中有三个未成对电子 |
| D、Bi基态原子最外层有5个能量相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置工作时,下列有关叙述正确的是( )
如图装置工作时,下列有关叙述正确的是( )| A、图1和图2中的溶液pH均增大 |
| B、图l和图2中的Fe极均被保护 |
| C、图l和图2中的负极反应均是Fe-2e-═Fe2+ |
| D、图1和图2烧杯中分别加入少量K3Fe{CN)6溶液均有蓝色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com