
| A. | 该有机物含碳.氢.氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳.氢原子个数之比是2:3 | |
| D. | 该有机物含2个碳原子,6个氢原子,但不能确定是否含氧原子 |
分析 根据水和二氧化碳的物质的量之比为3:2,可计算出分子中碳、氢两种原子个数比n(C):n(H)=n(CO2):2n(H2O)=2:6,因无论是否含有氧,都可燃烧生成二氧化碳和水,不能确定是否含有氧元素,以此解答该题.
解答 解:水和二氧化碳的物质的量之比为3:2,可计算出分子中碳、氢两种原子个数比n(C):n(H)=n(CO2):2n(H2O)=2:6,
A.该有机物完全燃烧只生成水和二氧化碳,说明一定含有C、H元素,但不能确定是否含有氧元素,故A错误;
B.该有机物完全燃烧只生成水和二氧化碳,说明一定含有C、H元素,而且分子中碳、氢两种原子个数比为2:6,但不能确定是否含有氧元素,所以不一定是乙烷,也可能为乙醇、二甲醚等,故B错误;
C.该有机物分子中碳、氢两种原子个数比为2:6,故C错误;
D.该有机物分子中碳、氢两种原子个数比为2:6,说明该化合物分子中含2个碳原子,6个氢原子,但不能确定是否含氧元素,故D正确;
故选:D.
点评 本题考查有机物燃烧的计算,为高频考点,侧重于学生的分析能力的考查,难度不大,注意利用原子守恒确定有机物分子中C、H原子个数之比,但不能确定是否含有氧元素.


科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
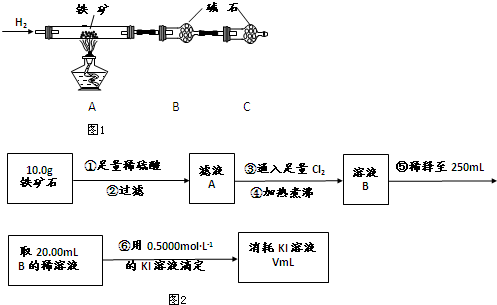
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
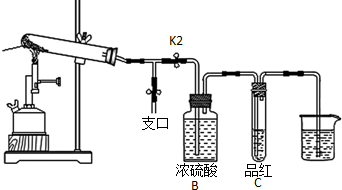
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 | B. | 770 | C. | 290 | D. | 292 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | B、E、J的离子半径由大到小顺序是E>J>B | |
| C. | G元素的单质不存在同素异形体 | |
| D. | B和J能形成既含离子键又含共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 原子晶体中的相邻原子间只存在非极性共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com