
����Ŀ��(1)д��NaHSO4��ˮ�еĵ��뷽��ʽ________��
(2)�����к�������CaCl2��MgCl2��һЩ�����Σ�Ҫ��ȥ��Щ���ʣ���ѡ�������Լ�����Na2CO3����NaOH����BaCl2����HCl �����Լ�������Ⱥ�˳����__________(�����)��
(3)2KMnO4+16HCl(Ũ) =2KCl+2MnCl2+5Cl2��+8H2O����˫���ŷ�����÷�Ӧ����ת�Ƶķ������Ŀ_______������0.1mol����ת��ʱ����Cl2�����Ϊ__________(��״��)����������HCl�����ʵ���Ϊ______________��
(4)ij��ɫ����Һ���ܺ���K+��Cu2+��Ca2+��SO42-��CO32-��Cl���еļ��֣��ֽ�������ʵ�飺
�ٵμ�BaCl2��Һ���а�ɫ�����������������˳���
�������������м���������ϡ���ᣬ�в��ֳ����ܽ⡣
������Һ����AgNO3��Һ���а�ɫ�������ɣ��ó���������ϡHNO3��
���жϣ�����Һ�п϶���__________���϶�û��_________��������_________�������ӷ��ţ���
���𰸡�NaHSO4=Na++H++SO42- �ڢۢ٢ܻ�ۢڢ٢ܻ�ۢ٢ڢ� 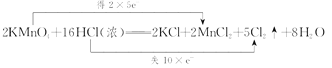 1.12L 0.1mol K+��SO42-��CO32- Cu2+��Ca2+ Cl-
1.12L 0.1mol K+��SO42-��CO32- Cu2+��Ca2+ Cl-
��������
(1)������NaHSO4��ˮ�еĵ��������������д���ӷ���ʽ��
(2)�����к�������CaCl2��MgCl2��һЩ�����Σ�̼���Ƴ�ȥ�����ӡ��Ȼ�����ȥSO42-��NaOH��ȥþ���ӣ����������ȥ̼���ƣ�ע��̼����һ�����Ȼ���֮��
(3)2KMnO4+16HCl(Ũ) =2KCl+2MnCl2+5Cl2��+8H2O�У�MnԪ�صĻ��ϼ���+7�۽���Ϊ+2�ۣ�ClԪ�صĻ��ϼ���-1������Ϊ0����ϻ��ϼ۱仯����Ӧ���㣻
(4)��ɫ��Һ�в��������ɫ��Cu2+�����ɵij�������ϡ������ܽ⣬�����ΪBaSO4��BaCO3�Ļ���ԭ��Һ�к���SO42-��CO32-���������ӹ����֪��Һ�в������Ca2+������Һ����AgNO3��Һ���а�ɫ�������ɣ��ó���ΪAgCl�����ڢ��м���BaCl2��Һ��������Cl-�������ж�ԭ��Һ���Ƿ��������ӣ���������ҺΪ�����Կ�֪һ������K+���ݴ˽��н��
(1)NaHSO4��ˮ����ȫ�������Na+��H+��SO42-������NaHSO4��ˮ�еĵ��뷽��ʽΪ��NaHSO4=Na++H++SO42-��
(2)�����к�������CaCl2��MgCl2��һЩ�����Σ�Na2CO3��ȥCa2+��BaCl2��ȥSO42-��NaOH��ȥMg2+�����������ȥ����Ĺ�����NaOH��Na2CO3��Ϊ����ʵ��������裬Na2CO3һ����BaCl2��Һ֮����룬����Լ��ļ���˳�����Ϊ�ڢۢ٢ܻ�ۢڢ٢ܻ�ۢ٢ڢܣ�
(3)�ڷ�Ӧ2KMnO4+16HCl(Ũ) =2KCl+2MnCl2+5Cl2��+8H2O�У���Ԫ�ػ��ϼ۴ӷ�ӦǰKMnO4��+7�۽��͵���Ӧ��MnCl2�е�+2�ۣ���õ���5e-��ClԪ�صĻ��ϼ��ɷ�ӦǰHCl����-1������Ϊ��Ӧ��Cl2��0�ۣ�ʧȥ����2��e-�����ϼ���������С��������10e-����˫���ŷ���ʾΪ�� �����ݷ���ʽ��֪��ÿ��10mol����ת�ƣ���10molHCl����������Ӧ����5molCl2������0.10mol���ӷ���ת��ʱ����������HCl��0.1mol���������������ʵ�����0.05mol�����ڱ�״���µ����ΪV=0.05mol��22.4L/mol=1.12L��
�����ݷ���ʽ��֪��ÿ��10mol����ת�ƣ���10molHCl����������Ӧ����5molCl2������0.10mol���ӷ���ת��ʱ����������HCl��0.1mol���������������ʵ�����0.05mol�����ڱ�״���µ����ΪV=0.05mol��22.4L/mol=1.12L��
(4)��ɫ������Һ�в����ܴ�����ɫ��Cu2+���μ�BaCl2��Һ���а�ɫ�������������ɵij�������ΪBaSO4��BaCO3������BaCO3������ϡ���ᣬ�������˳��������ij����ɲ�������ϡ���ᣬ˵������SO42-��CO32-���ӡ�����SO42-��CO32-����Ca2+��Ӧ����CaSO4��CaCO3���������ܴ������棬��һ������Ca2+���ӣ�������Һ������ԭ��֪����Һ��һ������������K+���ӣ�����Һ�м���AgNO3��Һ���а�ɫ�������ɣ�����ΪAg2SO4��Ag2CO3��AgCl���������ڼ���BaCl2��Һ������Cl-�����Բ���ȷ���Ƿ���Cl-���ӡ����Ը�������������֪����Һ��һ�����е�����Ϊ��K+��SO42-��CO32-��һ������������Ϊ��Cu2+��Ca2+�����ܺ��е�����ΪCl-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£��ֱ�SO2ͨ��100mL(NH4)2SO3��Һ��100mLNaOH��Һ�У������ҺpH���������ʵ��������ı仯��ϵ��ͼ����ͼ����֪Kb(NH3��H2O)=1.8��10-5������˵������ȷ���ǣ� ��
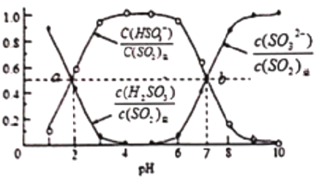
ͼ1��SO2ͨ��(NH4)2SO3��Һ��
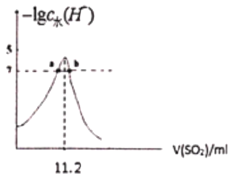
ͼ2��SO2ͨ��NaOH��Һ��
A. b��n(NH4+):n(HSO3-)=3��1
B. ��ͼ1�ɵ�Ka1(H2SO3)=10-2��Ka2(H2SO3)=10-7
C. ͼ2�У�b����Һ������
D. ��ͼ2�ɵ�NaOH��Һ��Ũ��Ϊ10mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ�������һ���µ����أ����������������Һ�ֿ�������ѭ����һ�ָ��������أ����������ߡ�ʹ������(����)�㡢ѭ��ʹ�����������ص㡣��ͼ��һ��п��Һ����أ����ҺΪ�廯п��ˮ��Һ������˵����ȷ����
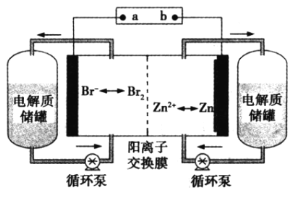
A�����ʱ�����ĵ缫��Ӧʽ��Zn-2e�� ![]() Zn2+
Zn2+
B�����ʱ�缫aΪ��ӵ�Դ�ĸ���
C���ŵ�ʱBr�����Ҳ�缫�ƶ�
D���ŵ�ʱ�����������ʴ����е�������Ũ�Ⱦ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ���ε�ˮ��Ӱ�죬�������ʾ���һ���ĸ����ԡ�
����0.1mol��L-1���ظ����(K2Cr2O7)��Һ�д�������ƽ�⣺
Cr2O72��+H2O![]() 2HCrO4��
2HCrO4��![]() 2CrO42��+2H��
2CrO42��+2H��
(1) K2Cr2O7��Һ��___�ԡ���ǿ����Һ�У���Ԫ�ص���Ҫ������ʽΪ______ (�����ӷ���)����K2Cr2O7��Һ�м�������ϡ���ᣬ��Һ��c(Cr2O72��)/c(CrO42��)��______(���������С�����䡱)��
(2)��K2Cr2O7��Һ�м���AgNO3��Һ���������ӻ�����Ӧ������ש��ɫ��������ҺpH��С�������ɵ�ש��ɫ�����Ļ�ѧʽΪ___________��
����֪25 ��ʱ��0.1 mol��L��1������Һ��pHԼΪ3�������м�������ƾ��壬�����ܽ����Һ��pH�����������������ֲ�ͬ�Ľ��ͣ�
��ͬѧ��������ˮ��ʼ��ԣ�������c(OH��)�������Һ��pH����
��ͬѧ������������ˮ�����������������ӣ������˴���ĵ��룬ʹc(H��)��С�������Һ��pH����
(1)Ϊ����֤�������ֽ�����ȷ������������ʵ�飺��0.1 mol��L��1�Ĵ�����Һ�м����������������е�________(��д���)��Ȼ��ⶨ��Һ��pH��(��֪25 ��ʱCH3COONH4��Һ������)
A������CH3COOK B������CH3COONH4
C������NH3 D������NaHCO3
��____(��ס����ҡ�)�Ľ�����ȷ����Һ��pHӦ_____(�������С�����䡱)��
(2)�����£���0.1 mol��L��1�Ĵ����0.1 mol��L��1��NaOH��Һ�������ϣ����û����Һ��pH��8��д���û����Һ��������ʽ�ľ�ȷ���(��ʽ)��
c(Na��)��c(CH3COO��)��____ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӱ�����ǵ�����ͽ�����������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȡ���˸�����Դ�ṹ���������ŵȴ�ʩ����Ч����PM2.5��SO2��NOx����Ⱦ����ش��������⣺
(1)��һ������ijPM2.5��Ʒ������ˮ�ܽ��Ƴɴ�������(����OH��)�������²�ø���������ɼ���Ũ�����±������ݱ��������жϸ�������pH=___________��
���� | K�� | Na�� | NH4�� | SO42�� | NO3�� | Cl�� |
Ũ��(mol��L-1) | 4��10��6 | 6��10��6 | 2��10��5 | 4��10��5 | 3��10��5 | 2��10��5 |
(2)����β����NOx��CO�����ɣ�
��֪����������NO�ķ�ӦΪ��N2(g)+O2(g) ![]() 2NO(g) ��H>0�����£������ܱ������У�����˵���У���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____��
2NO(g) ��H>0�����£������ܱ������У�����˵���У���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____��
A�����������ܶȲ��ٱ仯 B����������ѹǿ���ٱ仯
C��N2��O2��NO�����ʵ���֮��Ϊ1��1��2 D��������ת���ʲ��ٱ仯
(3)Ϊ����SO2���ŷţ���ϴ�Ӻ�SO2�����������п���Ϊϴ�Ӻ�SO2������ϴ�Ӽ��� ___________��
A��NaHCO3������Һ B��FeCl2������Һ C������CaCl2������Һ
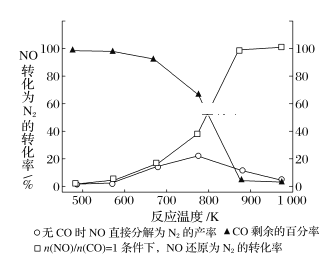
(4)����ʹ���Ҵ����Ͳ����ܼ���NOx���ŷţ���ʹNOx����Ч������Ϊ�����������Ҫ���⡣ij�о���С����ʵ������Ag-ZSM-5Ϊ���������NOת��ΪN2��ת�������¶ȱ仯�����ͼ��ʾ������ʹ��CO���¶ȳ���775K������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ___________________________________����n(NO)/n(CO)=1�������£�Ϊ���õij�ȥNOx���ʣ�Ӧ���Ƶ�����¶���_____K���ҡ�
(5)�����ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿(����������)��һ����������������E��F�����¶ȷֱ���T1�� ��T2��ʱ����ø�����ƽ��ʱ���ʵ���(n/mol)���±���
���� �¶ȡ� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.100 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ____________________ (E,F���û�ѧʽ��ʾ)��
����T1<T2����÷�Ӧ�Ħ�H___________0��(�>����<����=��)
�ۼ���������ӦT1��ʱ��ƽ�ⳣ��K=__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
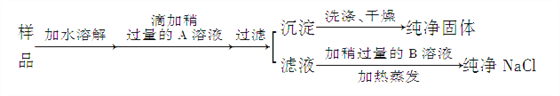
����Ŀ��ʳ�������������в���ȱ�ٵ����ʣ���ˮ�к��д���ʳ�Ρ�ij�س����Ĵ����У�����������CaCl2��ͨ�������ʵ����Ƶô�����NaCl��
��ش�
��1�������A��__________������A�ѹ����ķ�����___________��
��2�������B��__________�������Թ���B��Ŀ����__________��
��3��Ϊ��������Ƿ�ϴ������������ϴ��Һ�м���_________________��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п����Ӧ�ù㷺���ŵ�ʱ�ܷ�ӦΪZn+Ag2O2+H2O==Zn(OH)2+Ag2O��ijС������п����Ϊ��Դ���ö��Ե缫��ⱥ��Na2SO4��Һ�Ʊ�H2SO4��NaOH�������ͼ��ʾװ�á���ͨ��·������˵����ȷ��
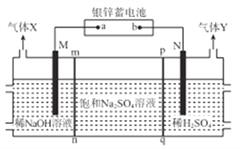
A. ��ص�a����ӦʽΪAg2O2+H2O+2e-=Ag2O+2OH-
B. ����YΪH2
C. pqĤ����ѡ�������ӽ���Ĥ
D. ���������65gZn������������1mol����X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ������ԭ��Ӧһ�������Ĵ������Ӧ����
B. ������ԭ��Ӧ�У���Ӧ�ﲻ�����������ǻ�ԭ��
C. ��������ԭ��Ӧ�У��������ͻ�ԭ���ȿ����Dz�ͬ����Ҳ������ͬ������
D. ʧ����Խ�࣬��ԭ��Խǿ���õ���Խ�࣬������Խǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�ֽ������ܶ�������Ӱ�졣ʵ���� 70��ʱ��ͬ������H2O2Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ����
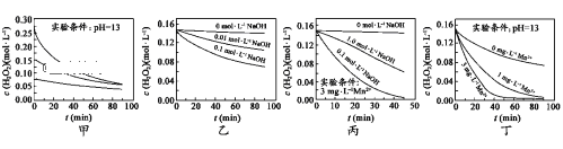
A. ͼ�ױ���������������ͬʱ��H2O2Ũ��ԽС����ֽ�����Խ��
B. ͼ�ұ���������������ͬʱ����ҺpHԽС��H2O2�ֽ�����Խ��
C. ͼ������������Mn2������ʱ����Һ����Խǿ��H2O2�ֽ�����Խ��
D. ͼ��������������Һ�У�Mn2��Խ��H2O2�ֽ�����Խ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com