
【题目】在一定温度下,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+) 与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(2)已知:25 ℃时,该电离平衡的平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________________mol·L-1 (用含a的代数式表示)。[提示:此时电离度比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为b mol·L-1,则此时c2(H+)=____________________mol·L-1(用含a、b的代数式表示)。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
【答案】小于 ![]() (1.75a×10-5)/b 大于
(1.75a×10-5)/b 大于
【解析】
(1)醋酸溶液的浓度越小电离程度越大,因此0.1mol/L的CH3COOH溶液与0.01mol/L的CH3COOH溶液中的c(H+)之比小于10,故答案为:小于;
(2)①根据CH3COOH![]() CH3COO- + H+,Ka=
CH3COO- + H+,Ka=![]() ,水电离出的c(H+)、c(OH-)忽略不计,则c(H+)= c(CH3COO),因此c(H+)=
,水电离出的c(H+)、c(OH-)忽略不计,则c(H+)= c(CH3COO),因此c(H+)=![]() 。c(H+)=
。c(H+)= ![]() =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
②Ka=![]() ,则c(H+)=
,则c(H+)=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
③加入一定量的CH3COONH4(假设溶液体积不变),醋酸离子浓度增大,醋酸电离平衡CH3COOH![]() CH3COO- + H+,逆向移动,氢离子浓度减小,所以c1(H+)>c2(H+),故答案为:大于。
CH3COO- + H+,逆向移动,氢离子浓度减小,所以c1(H+)>c2(H+),故答案为:大于。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)求原混合液中Na2SO4的物质的量?__________________
(2)产生的气体在标准状况下的体积为多少?_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )
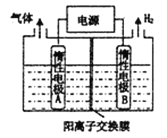
A. B极区电解液为LiOH溶液
B. 每产生2.24L氢气,就有0.2 mol阳离子通过交换膜进入阴极区
C. 电解过程中Li+向B电极迁移
D. 阳极电极反应式为2Cl--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C。若维持温度和压强不变,当达到平衡时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是( )
2C。若维持温度和压强不变,当达到平衡时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是( )
①原混合气体的体积为1.2V L ②原混合气体的体积为1.1V L ③反应达到平衡时气体A消耗掉0.05V L④反应达到平衡时气体B消耗掉0.05V L
A. ②③ B. ②④ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的_________。
A.用石斧解剖 B.早期的农业耕作
B.早期的农业耕作
C.简单机械织布![]() D.祥云火炬燃烧
D.祥云火炬燃烧![]()
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
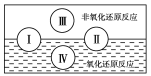
试写出一个有水生成的属于类型Ⅲ的化学方程式_________;
有水参加的反应:C+H2O(g)![]() CO+H2,符合图中反应类型______(填标号)。
CO+H2,符合图中反应类型______(填标号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探讨反应A(g)+2B(g) ![]() 2C(g)+D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图:图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。
2C(g)+D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图:图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。
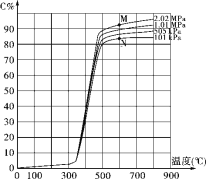
(1)该反应的反应热为ΔH_____0(填“>”、“<”或“=”)。
(2)点M和点N处平衡常数K的大小是:KM______KN(填“>”、“<”或“=”)。
(3)工业上进行该反应获得产品C的适宜条件是:度为______℃,选择该温度的理由是________________,压强为______,选择该压强的理由是__________________ 。
(4)试解释图中350℃前C%变化平缓而后急剧增大、500℃以后又缓慢增加的可能原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.cbdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) ![]() 2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化的数值 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0)kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C. 容器②中反应达到平衡时放出的热量为Q kJ
D. 若容器①体积为 0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是

A. 反应物分子(或离子)间的每次碰撞是反应的先决条件
B. 反应物的分子的每次碰撞都能发生化学反应
C. 活化分子具有比普通分子更高的能量
D. 活化能是活化分子的能量与分子平均能量之差,如图所示正反应的活化能为E-E1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com