Fe
2O
3、Cu
2O都是红色粉末,常用作颜料.某校化学实验小组通过实验来探究一红色粉末是Fe
2O
3、Cu
2O或二者混合物.探究过程如下:
查阅资料:Cu
2O 溶于稀硫酸生成Cu和CuSO
4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe
2O
3假设2:红色粉末是Cu
2O
(1)假设3:
红色粉末是Fe2O3和Cu2O的混合物
红色粉末是Fe2O3和Cu2O的混合物
.
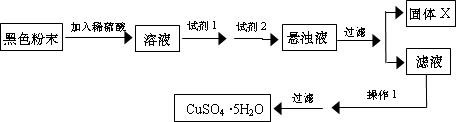
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液.
(2)若假设1成立,则实验现象是
溶液变为血红色
溶液变为血红色
.
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
不合理
不合理
.简述你的理由
Cu能将Fe3+还原为Fe2+
Cu能将Fe3+还原为Fe2+
.
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
Fe2O3和Cu2O的混合物
Fe2O3和Cu2O的混合物
,写出发生反应的离子方程式
Fe2O3+6H+=2Fe3++3H2O
Fe2O3+6H+=2Fe3++3H2O
、
Cu2O+2H+=Cu+Cu2++H2O
Cu2O+2H+=Cu+Cu2++H2O
、
2Fe3++Cu=2 Fe2++Cu2+
2Fe3++Cu=2 Fe2++Cu2+
.
探究延伸:经实验分析,确定红色粉末为Fe
2O
3和Cu
2O的混合物.
(5)实验小组欲用加热法测定Cu
2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu
2O的质量分数为
.