
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的________倍。
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO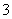 、CO
、CO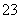 、SO
、SO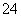 离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如下图所示:
离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如下图所示:
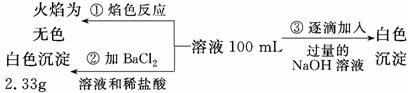
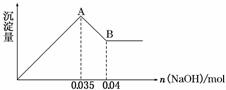
请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒 、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_________________________________________。
、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_________________________________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为____________________。
③试确定NO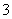 是否存在?________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO
是否存在?________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO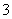 )=________(若不存在,此问不必作答)。
)=________(若不存在,此问不必作答)。
解析:(1)一个 ClO2生成Cl-,得到5个电子,一个Cl2生成2个Cl-,得到2个电子,所以ClO2的消毒效率是C l2的2.5倍。
l2的2.5倍。
(2)①需要100 mL容量瓶;②反应的离子方程式为Al(OH)3+OH-===AlO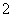 +2H2O;
+2H2O;
③无色废水→不含Fe3+ ;焰色反应无色→不含Na+;向废水中加过量氢氧化钠溶液有白色沉淀生成,且有部分溶解→含有Mg2+ 、 Al3+;溶液中含有Mg2+、Al3+,一定不含CO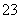 ;白色沉淀BaSO4 2.33 g的物质的量为0.01 mol→SO
;白色沉淀BaSO4 2.33 g的物质的量为0.01 mol→SO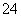 的物质的量也是0.01 mol。
的物质的量也是0.01 mol。
n(NaOH)=n(Al3+)=0.005 mol
n[Mg(OH)2]=n(Mg2+)=0.01 mol
设硝酸根离子的物质的量是X,根据溶液中阴阳离子电荷守恒知。
0.01×2+0.005×3=X+0.01×2 X=0.015 mol
答案:(1) 2.5 (2)①100mL容量瓶 ②Al(OH)3+OH-===AlO
2.5 (2)①100mL容量瓶 ②Al(OH)3+OH-===AlO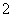 +2H2O ③ 存在 0.15 mol/L
+2H2O ③ 存在 0.15 mol/L


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
下列对有机化合物的分类结果正确的是
( )
A.乙烯CH2===CH2、苯、环己烷都属于脂肪烃
B.苯、环戊烷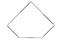 、环己烷同属于芳香烃
、环己烷同属于芳香烃
C.乙烯CH2===CH2、乙炔CHCH同属于烯烃
D.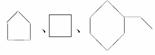 同属于环烷烃
同属于环烷烃
查看答案和解析>>
科目:高中化学 来源: 题型:
在灾后重建中,饮用水安全占有极为重要的地位, 某研究小组提取三处被污染的水源进行分析,并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液。
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解。
③进行焰色反应实验,只有B、C含有钾离子。
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀。
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验现象填写下列空白:
(1)写出B、C、D的化学式:B________、C________、D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________。
(3)写出实验②发生反应的离子方程式________________________________________
________________________________________________________________________。
(4)C常用作净水剂,用离子方程式表示其净水原理_______________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为1∶1∶6。下列有关该溶液的判断正确的是( )
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀氢氧化钠溶液,立即出现红褐色沉淀
C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为1
D.向该溶液中加入过量铁粉,只发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是( )
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)10Be和9Be________。
a.是同一种原子
b.具有相同的中子数
c.具有相同的化学性质
(2)Al和Be具有相似的化学性质,写出BeCl2水解反应的化学方程式_______________。
(3)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是_________
_______________________________________________________________。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中 放置已久的这两种元素的单质分别和热水作用
放置已久的这两种元素的单质分别和热水作用
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序________(用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干燥剂,此化合物的电子式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
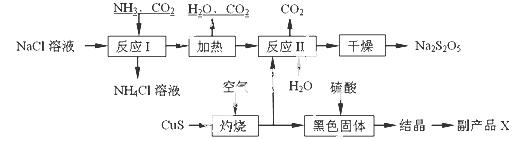
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是: ;可循环利用的物质是:__________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com