
| A. | 两者消耗NaOH的物质的量相同 | |
| B. | 中和HCl消耗NaOH的物质的量多 | |
| C. | 中和CH3COOH消耗NaOH的物质的量多 | |
| D. | 两者消耗NaOH的物质的量无法比较 |
分析 盐酸和醋酸都是一元酸,pH相同的HCl溶液和CH3COOH溶液,酸是弱电解质,氯化氢是强电解质,所以C(HCl)<C(CH3COOH),等体积的两种溶液,所以哪种溶液中含有溶质的物质的量多,其消耗的氢氧化钠的物质的量就多,据此分析解答.
解答 解:盐酸和醋酸都是一元酸,pH相同的HCl溶液和CH3COOH溶液,酸是弱电解质,氯化氢是强电解质,所以C(HCl)<C(CH3COOH),等体积的两种溶液 n(HCl)<n(CH3COOH),所以醋酸消耗的氢氧化钠多,
故选C.
点评 本题考查弱电解质的电离,明确“pH相同的相同元数的酸中,弱酸的物质的量浓度大于强酸”是解本题的关键,难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:填空题
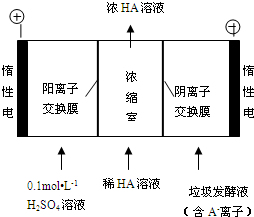
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
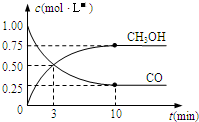 CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>c>d>b | B. | d>a>b>c | C. | d>b>a>c | D. | b>a>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2和Na2O2中都只含有离子键 | |
| B. | NaOH和NaHS都既含有离子键,又含有极性键 | |
| C. | CO2和H2S中都只含有非极性键 | |
| D. | H2O2和CS2都既含有极性键,又含有非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com