
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
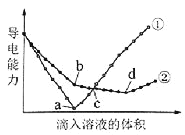
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
【答案】C
【解析】
A. a、b是滴入相同体积的H2SO4、NaHSO4溶液,Ba(OH)2与H2SO4刚好反应完,滴入H2SO4溶液时离子浓度下降大,溶液中几乎不导电,因此①代表滴加H2SO4溶液的变化曲线,故A正确;
B. b点是Ba(OH)2与NaHSO4按1:1反应,因此溶液中大量存在的离子是Na+、OH-,故B正确;
C. a点时Ba(OH)2溶液中OH-已消耗完,①中a点以后加入硫酸,则氢离子浓度和硫酸根浓度增加,而②中c点Ba(OH)2溶液中OH-还未消耗完,因此两溶液中c点含有的OH-量不同;故C错误;
D. a是Ba(OH)2与H2SO4按1:1反应,溶液显中性,d点是Ba(OH)2与NaHSO4按1:2反应,溶液显中性,故D正确。
综上所述,答案为C。


科目:高中化学 来源: 题型:
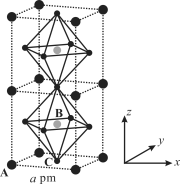
【题目】我国科学家成功合成了甲基胺离子导向的钙钛矿类杂化材料(CH3NH3)PbI3,该物质因具有较高的光电转换效率而在太阳能电池领域具有重要的应用价值。回答下列问题
(1)C、N基态原子中,第一电离能较大的是_____。
(2)CH3NH3+的电子式为_____,C、N原子的杂化轨道类型分别为______、______;CH3NH3+中,存在______(填代号)。
a.σ键 b.π键 c.配位键 d.氢键
已知甲基的供电子能力强于氢原子,则CH3NH2、(CH3)2NH中接受质子能力较强的是______。
(3)(CH3NH3)PbI3的立方晶格结构如图所示,其中B代表Pb2+,则______代表 I,每个晶胞中含有I 的数目为______。原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为(1/2,1/2,1/2),则C的原子分数坐标为______。已知(CH3NH3)PbI3的晶胞参数为a pm,晶体密度为 g·cm3,设NA为阿伏加德罗常数的值,则(CH3NH3)PbI3的摩尔质量为________g·mol1(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时 H2A 的pKa1=1.85,pKa2=7.19。常温下,用 0.1mol·L-1NaOH 溶封液滴定 20 mL 0.1 mol·L-1H2A 溶液的滴定曲线如图所示。下列说法不正确的是
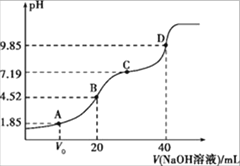
A.A 点 V0﹤10 mL线
B.B 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C.C 点所得溶液中:c(A2-)=c(HA-)
D.D 点所得溶液中:A2-水解平衡常数Kh1=10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物 L(![]() )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如图:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如图:

已知:①C、D、K 均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels﹣Alder 反应![]() +
+![]()
![]()
![]()
③ R2Cl![]() R1OR2
R1OR2
(1)I→J 的反应类型是________,D 的名称是________,G 中所含官能团的名称是________。
(2)B 的结构简式是________,“B→C”的反应中,除 C 外,另外一种产物是________。
(3)D+K→L 的化学方程式是________。
(4)M 为 D 的同分异构体,同时满足下列条件的 M 的结构简式为________。
①1 molM 最多消耗 4 mol NaOH ②核磁共振氢谱有 4 组吸收峰
(5)N 是 D 的同系物,相对分子质量比 D 大 14,则 N 可能的结构有________种。
(6)已知:乙炔与 1,3﹣丁二烯也能发生 Diels﹣Alder 反应。请以 1,3﹣丁二烯和乙炔为原料,选用必要的无机试剂合成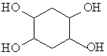 ,写出合成路线:________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线:________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体A在一种黄绿色气体B中可以安静的燃烧,发出苍白色火焰,反应生成气体C.B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,D与水反应又可生成A.试回答下列问题:

(1)写出下列物质的化学式:B________、C_________、E___________。
(2)写出B与水反应的离子方程式:_________________________________
(3)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____(填字母)
A.④和⑤ B.只有③ C.③和④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是制备精盐的实验方案,各步操作流程如下:
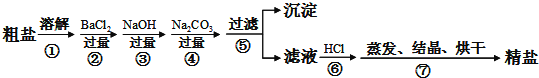
(1)第②步操作的目的是除去粗盐中的______(填化学式)。
(2)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、___(填化学式)。
(3)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是________。
(4)写出第⑥步反应的离子方程式_______________,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和CO2是碳的两种氧化物,请计算:
(1)在标准状况下,5.6LCO的物质的量是__________,质量是__________。
(2)11gCO2在标准状况下的体积是__________。
(3)相同物质的量的CO和CO2所含氧原子个数之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zewail创立的飞秒(![]() )化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如
)化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如![]() 与
与![]() 的反应过程片段为:
的反应过程片段为:![]() 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A.中间产物![]() 属于有机化合物
属于有机化合物
B.反应起点为![]() 离解为H和I自由基,终点为
离解为H和I自由基,终点为![]() 自由基与I自由基结合
自由基与I自由基结合
C.![]() 经1000fs离解为
经1000fs离解为![]() 自由基和
自由基和![]() ,说明
,说明![]() 与
与![]() 的反应速率极快
的反应速率极快
D.飞秒化学展现的反应历程为“化学反应实质是旧键断裂和新键形成”提供有力证据
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com