
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)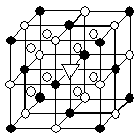
 的个数是
的个数是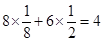 个,含有
个,含有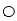 的个数是
的个数是 。根据化学式知,Na+和AlF6- 的个数比是3:1,则白色球和黑色球之比接近3:1,要使其为3:1,则▽所代表的应该是AlF6-。
。根据化学式知,Na+和AlF6- 的个数比是3:1,则白色球和黑色球之比接近3:1,要使其为3:1,则▽所代表的应该是AlF6-。

 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源:不详 题型:单选题

| A.最高价含氧酸的酸性:M>N |
| B.离子半径:X<Y |
| C.X和Y形成的化合物中一定含有含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y、Z、X、W的原子序数依次减小 |
| B.W与X可形成既含极性共价键又含非极性共价键的化合物 |
| C.由W、X、Y、Z四种元素组成的常见化合物一定显酸性 |
| D.X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5 、+3、 -3 | -2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.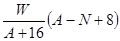 mol mol | B.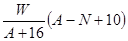 mol mol |
| C.(A-N+8)mol | D.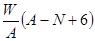 mol mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.②④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.在基态多电子的原子中,M层的电子能量肯定比L层上的电子能量高 |
| D.如果某一基态原子3p能级上仅有2个电子,它们自旋方向必然相反 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com