
| A、c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B、c(Na+)+c(H+)=c(Ac-)+c(Cl-) |
| C、c(Ac-)=c(Cl-)>c(H+)>c(HAc) |
| D、c(Ac-)>c(Cl-)>c(HAc)>c(H+) |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.08 | 1.6 | 1.6 |
| A、此时刻反应达到平衡状态 |
| B、容器内压强不变时,说明反应达平衡状态 |
| C、平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D、平衡时,反应混合物的总能量降低40kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
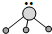 ,则以下叙述错误的是( )
,则以下叙述错误的是( )| A、R为三角锥形 |
| B、R可以是BF3 |
| C、R是极性分子 |
| D、键角小于109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 溴乙烷(Br2) | NaOH溶液 | 分液 |
| C | 乙醇(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | C2H5OH(H2O) | 新制生石灰 | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、邻二氯苯不存在同分异构体说明苯分子中6个碳原子之间的键是完全相同 | ||||
B、若乙酸分子中的O 都是
| ||||
| C、只用溴水就可以鉴别己烯、乙酸、苯、溴苯四种无色溶液或液体 | ||||
| D、硝基、羟基、乙基等都是官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2是还原产物 |
| B、KNO3被氧化 |
| C、转移电子的物质的量为5 mol |
| D、被氧化的N原子的物质的量为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、原子半径:W>Z>Y>X |
| D、1.0 L 0.1 mol?L-1戊溶液中阴离子总的物质的量小于0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学研究小组探究溴化亚铁水溶液与氯气反应.
某化学研究小组探究溴化亚铁水溶液与氯气反应.| 试验 | 操作 | 现象 |
| a | 取少量FeCl2溶液于试管中,滴加少量氯,再滴加2滴KSCN溶液,振荡静置. | 溶液变为血红色 |
| b | 取少量FeCl3溶液于试管中,滴加少量溴化钠溶液和少量CCl4,振荡静置. | CCl4层没有明显变化 |
| c | |
CCl4层由无色变为橙红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com