
| A.只用一种试剂无法鉴别甲酸、乙醛和乙酸 |
| B.向淀粉和稀硫酸混合加热后的溶液中加入银氨溶液并水浴加热,可以检验淀粉水解后的产物 |
| C.将乙醇与浓硫酸在170℃共热制得的气体通入酸性KMnO4溶液中,可以检验生成的乙烯气体 |
| D.用饱和Na2CO3溶液收集乙酸和乙醇反应生成的乙酸乙酯 |
科目:高中化学 来源:不详 题型:实验题
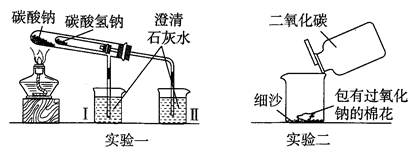
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ~3次一并转入其中。
~3次一并转入其中。| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制取蒸馏水时,为防止烧瓶内产生暴沸现象,应事先向烧瓶中加入几片碎瓷片 |
| B.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次 |
| C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |
| D.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③⑤①⑥⑦④ | B.④⑥①③②⑤⑦ |
| C.④②⑤⑥①③⑦ | D.②⑥⑦④③⑤① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 D.氢键 E.配位键 F.金属键 G.极性键
D.氢键 E.配位键 F.金属键 G.极性键
| | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
 萃取的效果 ▲ (填“好”或“差”)。
萃取的效果 ▲ (填“好”或“差”)。 馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代
馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代 号)。
号)。 冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 23.3g,则原混合物中氯化钾的质量分数为______。
23.3g,则原混合物中氯化钾的质量分数为______。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,称得质量为10.2g |
| B.用50mL酸式滴定管量取KOH溶液,体积为36.60mL |
C.用湿润的pH试纸测稀 盐酸溶液的pH,pH=3.52 盐酸溶液的pH,pH=3.52 |
| D.用10mL量筒粗略量取NaCl溶液,体积为9.2mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com