
【题目】有KOH和Ca(OH)2的混合溶液,c(OH﹣)=0.1 molL﹣1。取此溶液500 mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示。图中(V1)为112 mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
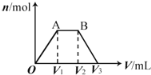
A. 560、672 B. 1008、1120 C. 2240、2352 D. 392、504
【答案】B
【解析】
向KOH和Ca(OH)2的混合稀溶液中通入CO2,二氧化碳先和氢氧化钙反应生成碳酸钙沉淀,当氢氧化钙消耗完时,继续通入二氧化碳,在碳酸钙沉淀溶解前二氧化碳和氢氧化钾反应生成碳酸钾,当氢氧化钾完全反应后,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,当碳酸钾反应后,继续通入二氧化碳,二氧化碳和碳酸钙、水反应生成可溶性的碳酸氢钙,然后根据相同条件下体积之比等于物质的量之比来解答。
有KOH和Ca(OH)2的混合溶液,c(OH﹣)=0.1 molL﹣1,取此溶液500mL,氢氧根离子的物质的量是:0.1mol/L×0.5L=0.05mol,OA段发生反应:Ca2++2OH-+CO2=CaCO3↓+H2O,消耗112mL(物质的量为0.005mol)CO2,所以n(Ca2+)=0.005mol,产生碳酸钙的物质的量为0.005mol,消耗了氢氧根离子是0.01mol,所以KOH中含有氢氧根离子的物质的量=0.05mol-0.01mol=0.04mol;AB段发生反应:OH-+CO2=HCO3-,消耗n(CO2)=0.04mol,标况下体积是:22.4L/mol×0.04mol=0.896L=896mL,V1为112mL,则V2=112mL+896mL=1008mL;B-最后段:CaCO3+H2O+CO2=Ca2++2HCO3-,碳酸钙溶解,消耗二氧化碳体积和OA段相等,即112mL,V3的体积为:1008mL+112mL=1120mL。
答案选B。


科目:高中化学 来源: 题型:
【题目】以硅藻土(主要成分为SiO2,含有少量的Fe2O3、 Al2O3) 为载体的V2O5-K2SO4常用作接触法制硫酸的催化剂。以下是一种废钒催化剂综合回收利用的工艺路线。

已知: 废钒催化剂中钒元素主要以VOSO4和V2O5形式存在;
V2O5是两性氧化物,不溶于水,溶于酸生成VO2+,溶于碱生成VO3-;
VOSO4是强电解质,溶于水电离出VO2+。
回答下列问题:
(1)VOSO4中V 元素的化合价为___________。
(2)滤渣①酸溶后加入的最佳试剂X 为_________。
a.NaClO b.Na2SO3c.K2SO3d.K2S
(3)从滤液③中得到产品K2SO4的操作为_________。滤渣③除含有V2O2(OH)4,还含有_________。
(4)若滤液⑤中c(VO3-)=0.1mol·L-1,为使钒元素的沉淀率达到98%,至少应调节c(NH4+)为_________[Ksp(NH4VO3)=1.6×10-3]。
(5)“焙烧”时通入足量的空气,反应后的尾气可以直接排放。该反应的化学方程式为____________。
(6) V2O5纯度测定原理: 称取V2O5产品ag,先加入硫酸将V2O5转化为VO2+,再加入V1 mLc1mol·L-1(NH4) 2Fe(SO4) 2溶液将VO2+转 化为VO2+,最 后 用c2mol·L-1KMnO4 溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液V2mL。假设杂质不参与反应,实验测得某V2O5产品的纯度为91%,则理论上加入(NH4)2Fe(SO4)2溶液的体积V1至少_________mL (用相关字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A.Al2(SO4)3=2Al3+ + 3SO42-B.NaHCO3=Na+ + HCO3-
C.Ba(OH)2= Ba2+ + 2 OH-D.H2SO4=H2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。

请填空:
(1)形成单质A的原子的结构示意图为________,它的最高化合价为________。
(2)B的化学式为_______________,B和碳反应生成A和E的化学方程式为_________________________。
(3)C的化学式为________,D的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组想利用高岭土(其主要成分是Al2O3·2SiO2·2H2O)实验新型的净水剂。实验程序如下:

其中滤液C就是欲求的净水剂,试回答下列问题:
(1)写出混合物A、B,滤液C、D的主要成分:
A:___________;B:___________;C:___________;D:___________。
(2)写出高岭土与烧碱熔融的两个化学方程式___________。
(3)该实验中,熔融高岭土可以选用的坩埚是______。
A.玻璃坩埚 B.瓷坩埚 C.氧化铝坩埚 D.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. M点时,Y的转化率最大
B. 升高温度,平衡常数减小
C. 平衡后充入Z,达到新平衡时Z的体积分数增大
D. W、M两点Y的正反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关键能(破坏1mol共价键吸收的能量)数据如表
化学键 | Si-O | O=O | Si-Si |
键能/kJmol-1 | X | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2kJmol-1,则X的值为( )
(已知1molSi中含有2molSi-Si键,1molSiO2中含有4molSi-O键)
A. 460 B. 423.3 C. 832 D. 920
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4v正(O2)=5v逆(NO)
B. 若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C. 若有5 mol O===O键断裂,同时有12 mol H—O键形成,此时必为化学平衡状态
D. 化学平衡时,化学反应速率关系是2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
(1)5min末A的物质的量浓度___________________;
(2)5min内D的平均化学反应速率____________________;
(3)B的转化率_____________________________;
(4)反应后容器中的总压强与反应前总压强之比为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com