
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.不符合反应客观事实,二者反应生成偏铝酸钠和水;
B.不符合反应客观事实,二者反应生成碳酸钠和水;
C.氢氧化钠少量反应生成碳酸钙和碳酸氢钠、水;
D.二者反应生成氢氧化铝沉淀和氯化铵;
解答 解:A.Al2O3和NaOH溶液反应,离子方程式:Al2O3+2OH-=2AlO2-+H2O,故A错误;
B.NaHCO3溶液与NaOH溶液反应,离子方程式:OH-+HCO3-═CO32-+H2O,故B错误;
C.Ca(HCO3)2溶液中加入少量NaOH溶液,离子方程式:Ca2++HCO3-+OH-═CaCO3↓+H2O,故C错误;
D.AlCl3溶液中加入足量的氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,掌握反应原理是解答本题的关键,注意离子反应遵循客观事实,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
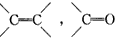 的不饱和度均为1,现有结构简式为
的不饱和度均为1,现有结构简式为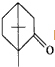 的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )
的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )| A. | 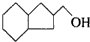 | B. |  | C. | 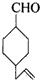 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L或5mol/L | B. | 3mol/L或5mol/L | C. | 1mol/L或3mol/L | D. | 3mol/L或7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
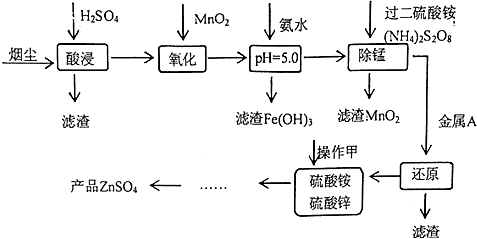
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2和Br2的沸点 | |
| B. | H-和Be2+的离子半径 | |
| C. | 同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4•5H2O的质量 | |
| D. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾的一种重要因素 | |
| B. | 食品中的抗氧化剂本身是难于氧化的物质 | |
| C. | 含SO42-的澄清溶液中不会含Ba2+ | |
| D. | 凡溶于水能电离出H+离子的化合物均属于酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com