
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
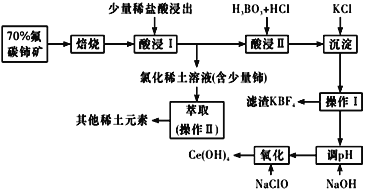
已知:铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液;
酸浸II中发生反应:
9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O;c(Ce3+)≤10-5 mol/L 时,完全沉淀。
请回答下列问题:
(1)①焙烧时先要将氟碳C矿粉碎,目的是 ___________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。 少量铈由CeO2进入稀土溶液发生反应的离子方程式是_______。
(3)向Ce(BF4)3中加入KCl溶液的目的是_________。
(4)操作I的名称为_________,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的 pH应大于______即可认为Ce3+已完全沉淀。{已知:Ksp[Ce(OH)3]=1.0 ×10-20}
(6)取上述流程中得到的Ce(OH)4产品5.00g,加酸溶解后,向其中加入含0.033 00 mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.100 0mol/L的酸性KMnO4标准溶液滴定至终点时,平均消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为______(保留2位小数,已知氧化性:Ce4+ >KMnO4;Ce(OH)4 的相对分子质量为208)
【答案】增大矿物接触面积,加快化学反应速率,使铈更充分的氧化为四价便于与其他稀土元素分离 2xCO + CeO2 = CeO2(1-x)+2xCO2↑ 2CeO2 +2Cl-+8H+ = 2Ce3+ + Cl2↑+4H2O 避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) 过滤 烧杯、分液漏斗 9 95.68%
【解析】
氟碳铈矿主要化学成分为CeFCO3经过煅烧,得到CeO2和CeF4,加入少量稀盐酸,分离出四价铈,再加盐酸和硼酸反应生成Ce(BF4)3和CeCl3,Ce(BF4)3沉淀加氯化钾转化为更难溶的KBF4和CeCl3溶液,调节pH值,再氧化变为Ce(OH)4。
⑴①根据上面分析,焙烧时先要将氟碳C矿粉碎,目的是增大矿物接触面积,加快化学反应速率,使铈更充分的氧化为四价便于与其他稀土元素分离;故答案为:增大矿物接触面积,加快化学反应速率,使铈更充分的氧化为四价便于与其他稀土元素分离。
②在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环,CO和CeO2反应生成二氧化碳,因此CeO2消除CO尾气的化学方程式:2xCO + CeO2 = CeO2(1-x)+2xCO2↑;故答案为:2xCO + CeO2 = CeO2(1-x)+2xCO2↑。
CeO2(1-x)+xO2↑的循环,CO和CeO2反应生成二氧化碳,因此CeO2消除CO尾气的化学方程式:2xCO + CeO2 = CeO2(1-x)+2xCO2↑;故答案为:2xCO + CeO2 = CeO2(1-x)+2xCO2↑。
⑵在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。是CeO2与盐酸反应生成三价铈、氯气和水,该反应的离子方程式是2CeO2 +2Cl-+8H+ = 2Ce3+ + Cl2↑+4H2O;故答案为:2CeO2 +2Cl-+8H+ = 2Ce3+ + Cl2↑+4H2O。
⑶向Ce(BF4)3中加入KCl溶液转化为KBF4和CeCl3,其目的是避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率);故答案为:避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率)。
⑷酸浸I,有不溶的难溶物,因此操作I的名称为过滤,在实验室中进行操作II是萃取,因此后面是分液,所需要的硅酸盐仪器有烧杯、分液漏斗;故答案为:过滤;烧杯、分液漏斗。
⑸![]() ,
,![]() ,
,![]() ,因此常温下加入NaOH调节溶液的 pH应大于9即可认为Ce3+已完全沉淀;故答案为:9。
,因此常温下加入NaOH调节溶液的 pH应大于9即可认为Ce3+已完全沉淀;故答案为:9。
⑹取上述流程中得到的Ce(OH)4产品5.00g,根据氧化性:Ce4+ >KMnO4;高锰酸钾氧化剩余亚铁离子,根据关系式5 Fe2+— MnO4-,高锰酸钾消耗得亚铁离子的物质的量n(Fe2+)=5n(MnO4-)=5×0.100 0mol/L×0.02L=0.01mol,根据Ce4+ + Fe2+ = Ce3++ Fe3+,n(Ce4+)=0.033mol -0.01mol =0.023mol,则该产品中Ce(OH)4的质量分数为![]() ;故答案为:95.68%。
;故答案为:95.68%。


科目:高中化学 来源: 题型:
【题目】氢氧化镁:①是中强碱;②广泛用作阻燃剂和填充剂.以白云石(化学式:MgCO3CaCO3)为原料制备氢氧化镁的工艺流程如下:

(1)根据流程图,白云石“轻烧”后固体产物的主要成份是MgO和_______(写化学式)。
(2)流程图中“加热反应”有氨气生成的化学方程式为_________________________。
(3)洗涤Mg(OH)2沉淀所用玻璃仪器有:_______、烧杯、玻棒;检验洗净的方法是____________。
(4)传统工艺是将白云石高温分解为氧化镁和氧化钙后提取,而该工艺采用轻烧白云石的方法,其优点是__________________。
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10﹣4mol/L,Mg(O2)22﹣、Mg(OH)42﹣的浓度共为2.35×10﹣4mol/L,则溶液的pH=_______(取整数值);若经过循环利用,每制得5.8t Mg(OH)2时排出200m3的废水,其中Mg2+、Mg(O2)22﹣、Mg(OH)42﹣的浓度共为1.50×10﹣4mol/L,则该工艺的产率为___________(保留4位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中的没食子儿茶素(EGC)结构如图所示.关于EGC的下列叙述中正确的是( )
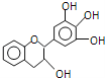
A.EGC的分子式为C15H14O5,属于芳香烃类化合物
B.1molEGC与4molNaOH恰好完全反应
C.该物质能够发生取代反应、加成反应、氧化反应、还原反应、显色反应
D.分子中所有的原子处在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+CO2↑
2Na2SiO3+CaSiO3+CO2↑
(1)某反应物在熔融状态下不导电,它属于___晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为___。
(3)碳和硅属于同族元素,该族元素的原子最外层轨道表示式为___。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:___。
(5)CO2的电子式为___。
(6)反应物Na2CO3和CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿垃圾又称为厨余垃圾,厨余垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。 下列说法正确的是( ).
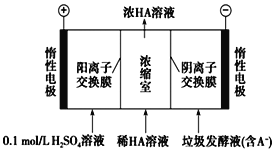
A.当有11.2LO2生成时,电路中通过2 mol e-的电量
B.电子从负极经电解质溶液回到正极
C.通电后,A-通过阴离子交换膜从阴极区进入浓缩室
D.通电后,阳极附近pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )

A.盐酸中逐滴加入食盐溶液
B.醋酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.醋酸中逐滴加入氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com