
在2 L密闭容器中进行反应:
mX(g)+nY(g)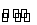 pZ(g)+qQ(g),式中m,n,p,q为物质的化学计量数。在0~3 min 内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m,n,p,q为物质的化学计量数。在0~3 min 内,各物质物质的量的变化如下表所示:
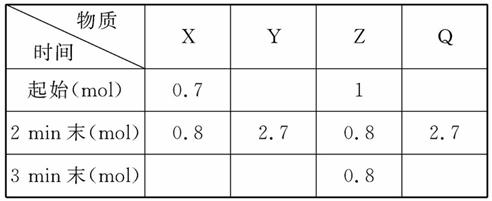
已知2 min内v(Q)=0.075 mol·L-1·min-1,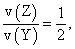
(1)试确定以下物质的相关量:
起始时n(Y)=__________,n(Q)=________。
(2)方程式中m=__________,n=_________,
p=____________,q=___________。
(3)用Z表示2 min内的反应速率_________。
(4)2 min末Q的转化率为____________。
(5)试判断在2 min内v(正)________v(逆)(填“>”“<”或“=”),在2 min末~3 min末v(正)_________v(逆)(填“>”“<”或“=”)。
【解析】本题考查化学反应速率的简单计算。解题时明确化学反应速率与化学计量数的关系以及化学计算的方法。对比X的起始量和2 min末的量,可知反应逆向进行。
Δn(Q)=v(Q)·V·Δt
=0.075 mol·L-1·min-1×2 L×2 min=0.3 mol
对反应过程作“三段式”法分析如下:
mX + nY 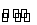 pZ + qQ
pZ + qQ
始/mol 0.7 n(Y) 1 n(Q)
变/mol Δn(X) Δn(Y) Δn(Z) 0.3
2 min末/mol 0.8 2.7 0.8 2.7
故Δn(X)=0.8 mol-0.7 mol=0.1 mol
Δn(Z)=1 mol-0.8 mol=0.2 mol
n(Q)=0.3 mol+2.7 m ol=3 mol
ol=3 mol
(1)因
故
Δn(Y) =0.1 mol·L-1·min-1×2 min×2 L=0.4 mol
=0.1 mol·L-1·min-1×2 min×2 L=0.4 mol
n(Y)=2.7 mol-0.4 mol=2.3 mol
(2)m∶n∶p∶q=Δn(X)∶Δn(Y)∶Δn(Z)∶Δn(Q)
=0.1 mol∶0.4 mol∶0.2 mol∶0.3 mol
=1∶4∶2∶3
(3) v(Q)
v(Q) =0.075 mol·L-1·min-1,
=0.075 mol·L-1·min-1,
故v(Z)=0.05 mol·L-1·m in-1。
in-1。
(4)Q的转化率
(5)起始时反应逆向进行,至2 min末Z的物质的量不再变化,达到平衡状态,故2 min内v(正)<v(逆),2 min末~3 min末反应处于平衡状态,故v(正)=v(逆)。
答案:(1)2.3 mol 3 mol
(2)1 4 2 3
(3)0.05 mol·L-1·min-1
(4)10% (5)< =


科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2 L CO2所含的原子数为1.5NA
B.常温常压下,48 g O3含有的氧原子数为3NA
C.标准状况下,22.4 L H2O所含分子数为NA
D.标准状况下,22.4 L H2中所含原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:
①Cu2O+2H+===Cu+Cu2++H2O;
②部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
注:金属离子的起始浓度为0.1 mol·L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为__________________。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是________。
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是__________;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是__________________。
(4)Ⅳ中加NaClO的目的是______________。
(5)由上述实验可以获得结论:原样品所有可能的成分组合为____________;________________。(用化学式表示、任写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的物质的量,横坐标为加入物的体积)不正确的是
( )
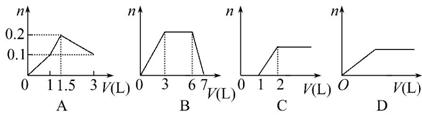
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合液加入0.1 mol·L-1
稀硫酸
B.向1 L含有0.1 mol·L-1AlCl3和0.3 mol·L-1NH4Cl的混合液中加入0.1 mol·L-1
NaOH溶液
C.向烧碱溶液滴加明矾溶液
D.向AlCl3溶液滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H2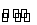 2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反
2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反 应已达到平衡状态的是( )
应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
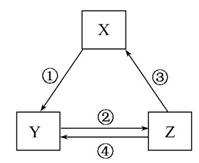
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是( )
| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温加水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Fe | FeCl2 | FeCl3 | ④加入铁粉 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属腐蚀与防护的说法正确的是( )
A.金属腐蚀就是金属失去电子被还原的过程
B.铝制品的耐腐蚀性强,说明铝的化学性质不活泼
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.钢铁锈蚀时,铁原子失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组用如图所示装置制取氯气,下列说法不正确的
是( )
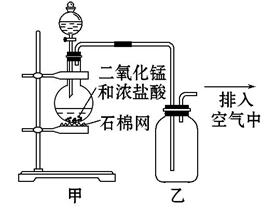
A.该装置图中至少存在两处明显错误
B.将烧瓶中的MnO2换成KMnO4可制得Cl2
C.在乙后连一盛有饱和食盐水的烧杯进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com