
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 设A、B的起始物质的量分别为2mol、1mol,平衡时转化的A为2mol×$\frac{1}{2}$=1mol,则:
3A(气)+B(气)?nC(气)+2D(气)
起始量(mol):2 1 0 0
变化量(mol):1 $\frac{1}{3}$ $\frac{1}{3}$n $\frac{2}{3}$
平衡量(mol):1 $\frac{2}{3}$ $\frac{1}{3}$n $\frac{2}{3}$
再根据混合气体平均相对分子质量增大了$\frac{1}{8}$倍列方程计算解答.
解答 解:设A、B的起始物质的量分别为2mol、1mol,平衡时转化的A为2mol×$\frac{1}{2}$=1mol,则:
3A(气)+B(气)?nC(气)+2D(气)
起始量(mol):2 1 0 0
变化量(mol):1 $\frac{1}{3}$ $\frac{1}{3}$n $\frac{2}{3}$
平衡量(mol):1 $\frac{2}{3}$ $\frac{1}{3}$n $\frac{2}{3}$
再根据混合气体平均相对分子质量增大了$\frac{1}{8}$倍,根据M=$\frac{m}{n}$可知,$\frac{m}{3}$×(1+$\frac{1}{8}$)=$\frac{m}{1+\frac{4}{3}+\frac{1}{3}n}$,解得n=1,
故选:A.
点评 本题考查化学平衡计算,关键是判断反应前后气体物质的量关系,掌握三段式在化学平衡计算中应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
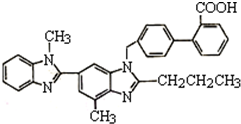 替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )| A. | 该物质属于芳香族化合物 | |
| B. | 能发生加成反应、取代反应和酯化反应 | |
| C. | 替米沙坦的分子式为C32H28O2N4 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A. | 15.7 g混合物恰好与盐酸完全反应 | |
| B. | NaHCO3占混合物的物质的量分数为50% | |
| C. | 盐酸的物质的量浓度为3.0 mol/L | |
| D. | 加入混合物9.2 g时盐酸过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验NH4+时,加浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝,则可证明原溶液中含有NH4+ | |
| B. | 检验SO42-时,加入BaCl2溶液,再加稀硝酸,若沉淀不消失,则可证明含SO42- | |
| C. | 用天平和小烧杯称量5.40gNaOH固体 | |
| D. | 用饱和FeCl3溶液中逐滴滴加NaOH溶液,至溶液呈红褐色即可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.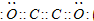 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | Kw/c(OH-)=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com