
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
|
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 |
|
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
|
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 |
|
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
考点:
原子结构与元素周期律的关系;原子结构与元素的性质.
分析:
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素.
解答:
解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素,
A.非金属性X(O)>W(S),故W元素的简单气态氢化物的还原性比X的弱,故A错误;
B.非金属Z(Si)<W(S),故硫酸的酸性比硅酸强,故B错误;
C.MgO含有离子键,SiO2、SO3含有共价键,故C错误;
D.同周期自左而右,原子半径减小,同主族电子层越多原子半径越大,故原子半径Mg>Si>S>O,即rY>rZ>rW>rX,故D正确,
故选:D.
点评:
本题考查结构性质与位置关系、元素周期律等,难度不大,推断元素是解题的关键.


科目:高中化学 来源: 题型:
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
|
| A. | H2SO3>I﹣>Fe2+>NO | B. | I﹣>Fe2+>H2SO3>NO |
|
| C. | Fe2+>I﹣>H2SO3>NO | D. | NO>Fe2+>H2SO3>I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+3B(g)⇌2C(g)(正反应为放热反应),两容器中C的体积分数与时间的关系如图所示,则a、b两线不同的可能原因是( )
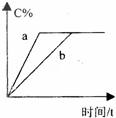
|
| A. | a的温度高于b | B. | a使用了催化剂,而b未用 |
|
| C. | a的压强大于b | D. | a的温度低于b |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项比较中前者高于(或大于或强于)后者的是( )
|
| A. | CCl4和SiCl4的熔点 |
|
| B. | 邻羟基苯甲醛( |
|
| C. | SO2和CO2在水中的溶解度 |
|
| D. | H2SO3和H2SO4的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是( )
|
| A. | 根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
|
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
|
| C. | 晶体中一定存在化学键 |
|
| D. | 正四面体分子中键角只能是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”“小”).
(2)TY2中心原子的杂化方式为 ;XY2中一个分子周围有 个紧邻分子;堆积方式与XY2晶胞类型相同的金属有 (从“Cu、Mg、K、Po”中选出正确的),其空间利用率为 .
(3)Z的第一电离能比Mg的 (填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 .
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是,原因是 .
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T.已知:
XO(g)+1/2O2(g)═XO2(g)△H=﹣283.0kJ•mol﹣1
T(s)+O2(g)═TO2(g)△H=﹣296.0kJ•mol﹣1
此反应的热化学方程式是 .
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方PT晶体结构如下图所示,其晶胞边长为540.0pm,密度为 g•cm﹣3(列式并计算).
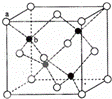
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是( )
|
| A. | CaO+H2O=Ca(OH)2 | B. | NaCl+AgNO3=NaNO3+AgCl↓ |
|
| C. | H 2CO3=H2O+CO2↑ | D. | H2+CuO=Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是( )
|
| A. | H2(g)+Cl2(g)=2HCl(g);△H=﹣184.6kJ/mol |
|
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=﹣802.3kJ/mol |
|
| C. | 2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJ/mol |
|
| D. | CO(g)+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com