
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为56,中子数为30 |
 ;
;分析 X、Y、Z、W是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,则Y为硫元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;W的一种核素的质量数为56,中子数为30,则其质子数=56-30=26,则W为Fe元素,据此解答.
解答 解:X、Y、Z、W是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,则Y为硫元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;W的一种核素的质量数为56,中子数为30,则其质子数=56-30=26,则W为Fe元素.
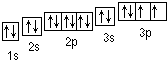
(1)Y为S元素,轨道表示式为 ,
,
故答案为: ;
;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:S>Cl>C,
故答案为:S>Cl>C;
(3)CS2的结构式为S=C=S,分子中存在2个σ键,分子的空间构形为直线形结构,在H-S、H-Cl两种共价键中,S原子半径大于Cl原子的,故H-S的键长较长,
故答案为:2;直线形;H-S;
(4)Fe3+的核外电子排布式是:1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d5;
(5)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S,C元素被氧化为二氧化碳,此反应的化学方程式是:2CO+SO2=S+2CO2,
故答案为:2CO+SO2=S+2CO2;
(6)在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强,
故答案为:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意金属性、非金属强弱比较实验事实,注意基础知识的全面掌握.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a电极与电源的负极相连 | |
| B. | t2时,两电极的质量相差3.84 g | |
| C. | 电解过程中,溶液的pH不断增大 | |
| D. | t2时,b电极的电极反应是2H2O-4e-=2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O+HCl═NH4Cl+H2O | B. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | ||
| C. | Al(OH)3+3HCl═AlCl3+3H2O | D. | KOH+HNO3═KNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气和氢气的混合气体含有2NA个原子 | |
| B. | 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 1molFeI2与1molCl2反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol•L-1]随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol•L-1]随时间t(min)的变化关系如图所示.下列说法正确的是( )| A. | 压强:p(甲)<2p(乙) | |
| B. | 热量:Q(甲)<2Q(乙) | |
| C. | 乙中前5min内的反应速率v(O2)=0.10mol•L-1•min-1 | |
| D. | 保持其他条件不变,若起始时向乙中充入0.4molSO2、0.2molO2、0.4molSO3,则此时v(正)<v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com