
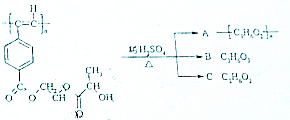
 聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,如图是聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解示意图:
聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,如图是聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解示意图: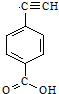 ;
;分析 由高聚物M的结构简式可知M水解可生成 、HOCH2CH2OH和CH3CHOHCOOH,由此可知A为
、HOCH2CH2OH和CH3CHOHCOOH,由此可知A为 ,B为CH3CHOHCOOH,C为HOCH2CH2OH,结合有机物的结构和官能团的性质解答该题.
,B为CH3CHOHCOOH,C为HOCH2CH2OH,结合有机物的结构和官能团的性质解答该题.
解答 解:(1)由高聚物M的结构简式可知M是通过C≡C的加聚反应生成的;
故答案为:加聚反应;
(2)A的结构简式为 ,A通过C≡C的加聚反应生成的,所以其单体为
,A通过C≡C的加聚反应生成的,所以其单体为 ;
;
故答案为: ;
;
(3)1mol M中含有1mol-OH,则消耗1mol钠;1molM与热的烧碱溶液反应,发生水解生成2nmol羧基,则可消耗2nmol的NaOH;
故答案为:1、2n.
点评 本题考查有机物的结构与性质,题目难度中等,解答时注意根据官能团的性质以及转化判断,注意把握题给信息,为解答该题关键,注意知识的迁移和应用.


科目:高中化学 来源: 题型:选择题
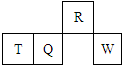 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | W对应的单质只可以跟强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏水 | B. | 糖水 | C. | 水银 | D. | 水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当该卤代烃发生取代反应时,被破坏的键是①和③ | |
| B. | 当该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键② | |
| D. | 当该卤代发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度 实验次数 | 起始温度t1/℃ | 终止温度t℃/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白炽灯工作时,电能全部转化为光能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,化学能主要转化热能 | |
| D. | 电解水生成H2和O2时,电能主要转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com