
下列判断合理的是( )
A.Na2O2、Fe2O3和A12O3属于碱性氧化物
B.蔗糖、硫酸钠和硫酸钡分别属于非电解质、强电解质和弱电解质
C.根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
D.根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2016-2017学年四川省高一11月月考化学卷(解析版) 题型:选择题
下列说法正确的有( )
A.NH3、CO2溶于水可以导电,因此为电解质
B.焰色反应是某种金属元素灼烧时所具有的特殊颜色,是物理变化
C.强氧化剂与强还原剂之间一定能发生氧化还原反应
D. 阳离子只能得电子被还原,阴离子只能失电子被氧化
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
分别依据下列实验事实,得出的结论正确的是
实验事实 | 结论 | |
A | 将通入溴水中二氧化硫,溴水褪色 | 二氧化硫有漂白性 |
B | 淀粉与稀硫酸共热,再加银 | 淀粉没有水解 |
C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 向1mL 0.1 mol/L的AgNO3溶液中加入1 mL 0.1 mol/L NaCl溶液,出现白色沉淀,再加几滴0.1 mol/L Na2S溶液,有黑色沉淀生成 | 氯化银的溶解度大于硫化银 |
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:选择题
《自然》杂志在线发表了由中美两国华人科学家共同完成的一项突破“快速充放电铝离子电池”,其原理如下图所示。下列有关说法正确的是( )

A.电池放电时,负极反应式:Al-3e-=Al3+
B.电池充电时,电池正极(石墨)上发生还原反应
C.电池充电时,电路中每转移0.3 mol电子,理论上生成2.7g Al
D.离子液体是一种能导电的物质,电池充电时,离子液体中EMI+向石墨电极移动
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,它们分别位于不同的主族。X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的最外层电子数相等,X与W所在族序数之和等于10。下列说法正确的是( )
A. 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. 沸点:XW2<Y2W
C. 最高价氧化物对应的水化物的酸性:X>Z
D. 简单氢化物的热稳定性:Z>W
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:推断题
A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族。
(2)反应①的离子方程式为 ;
反应②的离子方程式为 ;
反应③的离子方程式为 ;
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式 ;
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为 静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列叙述错误的是( )
A.10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480mL,需用500ml容量瓶
C.在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.同温同压下,20mLCH4和60mLO2所含的原子数之比为5:6
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:实验题
NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反 应发生、气体收集和尾气处理装置依次为_____________。
应发生、气体收集和尾气处理装置依次为_____________。
(2)按下图装置进行NH3性质实验。
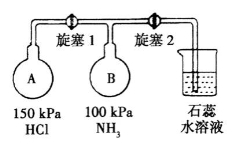
①先打开旋塞1,B瓶中的现象是_______________,原因是____________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是_____________。
(3)设计实验,探究某一种 因素对溶液中NH4Cl水解程度的影响。
因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。
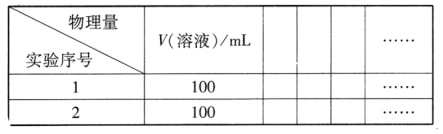
③按实验序号I所拟数据进行实验,若读取的待测物理 量的数值为Y,则NH4Cl水解反应得平衡转化率为______________ (只列出算式,忽略水自身电离的影响)。
量的数值为Y,则NH4Cl水解反应得平衡转化率为______________ (只列出算式,忽略水自身电离的影响)。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:实验题
化学实验是研究化学反应的有效方法。
Ⅰ.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
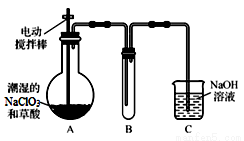
(1) 实验时装置A需在60℃~100℃进行的原因是 ,控制所需温度的方法是 。
实验时装置A需在60℃~100℃进行的原因是 ,控制所需温度的方法是 。
(2)电动搅拌棒的作用是 。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为 。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式 。
Ⅱ. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是_______________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
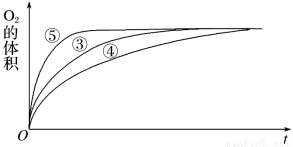
分析上图能够得出的实验结论是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com