
| 实验步骤 | 实验现象 |
| ①a和b相混合 | 气体变为红棕色 |
| ②c和d相混合 | 产生白烟 |
| ③c、e分别通入少量溴水中 | 都变成无色透明的溶液 |
| ④b、e分别通入氢硫酸中 | 都产生淡黄色的浑浊 |
| A. | O2、NO、HCl、NH3、CO2 | B. | O2、NO、NH3、HCl、SO2 | ||
| C. | NO、O2、NH3、HCl、SO2 | D. | HBr、Cl2、NH3、H2S、C2H4 |
分析 由①a和b相混合,气体为红棕色,则生成NO2,a和b中有一种必为NO气体,另一种为O2气体;由②c和d相混合,产生白烟可知,生成固体,则c和d中有一种必为NH3气体,另一种为HCl气体;由③c、e分别通入少量溴水中,均为无色溶液,可知c为NH3,则d为HCl,e为SO2等;由④b、e分别通入氢硫酸中,都产生淡黄色的浑浊,则b为O2,以此来解答.
解答 解:由①a和b相混合,气体为红棕色,则生成NO2,a和b中有一种必为NO气体,另一种为O2气体;
由②c和d相混合,产生白烟可知,生成固体,则c和d中有一种必为NH3气体,另一种为HCl气体;
由③c、e分别通入少量溴水中,均为无色溶液,可知c为NH3,则d为HCl,e为SO2等;
由④b、e分别通入氢硫酸中,都产生淡黄色的浑浊,b、e具有氧化性,则b为O2,e为SO2,可知a为NO,
综上所述,a、b、c、d、e依次可能是NO、O2、NH3、HCl、SO2,
故选C.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物一定是非金属氧化物;金属氧化物一定是碱性氧化物 | |
| B. | 渗析可用于提纯胶体;用丁达尔效应可以鉴别溶液和胶体 | |
| C. | 某元素从游离态变为化合态,该元素可能被氧化,也可能被还原 | |
| D. | SO2的任意排放会形成酸雨,氮氧化物的任意排放会形成光化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
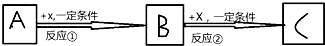
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验.
某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
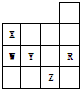
| A. | 常压下五种元素的单质中Z单质的沸点最高 | |
| B. | X和W的常见单质的分子式分别为X2和W2 | |
| C. | W的氢化物沸点比X的氢化物的沸点低 | |
| D. | R最高氧化物水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
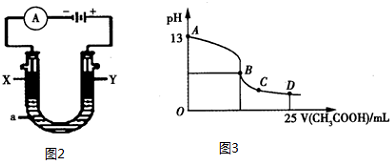
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com