
分析 ①由两种或两种以上物质构成的是混合物;
②只由一种物质构成的是纯净物;
③只由一种元素形成的纯净物为单质;
④由两种或两种以上元素形成的纯净物为化合物;
⑤由两种元素组成,其中一种为氧元素的化合物为氧化物.
解答 解:①由两种或两种以上物质构成的是混合物,故b牛奶、c自来水、h加碘食盐是混合物,故答案为:bch;
②只由一种物质构成的是纯净物,故a干冰、d氮气、e氧化钠.f高锰酸钾 g水银、i硫酸铜均为纯净物,故答案为:adefgi;
③只由一种元素形成的纯净物为单质,故d氮气、g水银 是单质,故答案为:dg;
④由两种或两种以上元素形成的纯净物为化合物,故a干冰、e、氧化钠、f高锰酸钾、i硫酸铜是化合物,故答案为:aefi;
⑤由两种元素组成,其中一种为氧元素的化合物为氧化物,故a干冰、e氧化钠是氧化物,故答案为:ae;
点评 本题考查了氧化物、混合物、纯净物和单质与化合物的概念以及物质的分类,应注意的是单质和化合物一定是纯净物,氧化物一定是化合物.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
| 编号 | 镁粉/g | H2O/mL | NH4Cl溶液/mL | NH4NO3溶液/mL |
| ① | 5 | 0 | 20 | 0 |
| ② | 5 | 0 | 0 | 20 |
| ③ | 5 | 20 | 0 | 0 |
| 实验步骤(不要求写出具体操作过程): 增加一组镁与NaCl溶液的作用的实验 实验结论常温下镁几乎不和NaCl溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
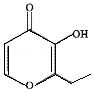 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H7O3 | |
| B. | 1mol该有机物最多能与2mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成和氧化反应 | |
| D. | 该有机物的一种含苯环的同分异构体能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
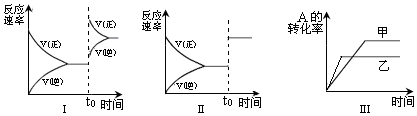
| A. | 图I研究的是t0时刻增大A的浓度对反应速率的影响 | |
| B. | 图II研究的是t0时刻加入催化剂或通入氦气使压强增大后对反应速率的影响 | |
| C. | 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高 | |
| D. | 图III研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00mL 蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | NO2和溴蒸气都呈红棕色,用水可鉴别NO2和溴蒸气 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和FeSO4溶液 | |
| D. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y<Z<X | B. | X<Y<Z | C. | Z<Y<X | D. | X<Z<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 、
、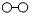 、
、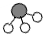 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
| A. | 催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 | |
| D. | 使用催化剂,合成氨反应放出的热量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取并收集干燥纯净的NH3 | B. |  模拟海水蒸馏 | ||
| C. | 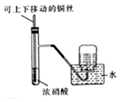 收集NO2气体 | D. |  包有足量Na2O2的脱脂面燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com