
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
| c(Br-) |
| c(Cl-) |
| ||
|
| 5.4×10-13 |
| 2.0×10-10 |


科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对,有 |
| B | Cl2与SO2混合后可漂白纸张 | Cl2和SO2有较好的漂白作用 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ对,无 |
| D | 溴化银常用作感光材料 | 溴化银固体被保存在棕色细口瓶中 | Ⅰ对,Ⅱ对,有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
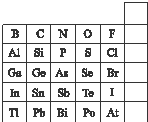 元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:查看答案和解析>>
科目:高中化学 来源: 题型:
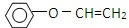 )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题: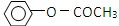 )的流程如下(条件略)
)的流程如下(条件略)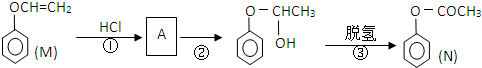
查看答案和解析>>
科目:高中化学 来源: 题型:
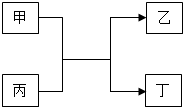 甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.
甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com