
 己知A为单质,B、C、D、E为化合物.它们之间存在如图转化关系:
己知A为单质,B、C、D、E为化合物.它们之间存在如图转化关系:分析 己知A为单质,B、C、D、E为化合物,
(1)D为无色气体,在空气中可变成红棕色,则D为NO,B为镁条在空气中燃烧的产物之一,其与水反应可生成气体C,C与HCl气体反应生成E时产生大量白烟,则B为Mg3N2,Mg3N2与水反应生成C为NH3,NH3与HCl气体反应生成E为NH4Cl,A为非金属单质,所以A为N2;
(2)C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,将C滴入沸水中可得E的胶体,则D为Fe2O3,C为FeCl3,E为Fe(OH)3,A为生活中常见的金属单质,则A为Fe,B为A与盐酸反应的产物,则B为FeCl2,据此答题.
解答 解:己知A为单质,B、C、D、E为化合物,
(1)D为无色气体,在空气中可变成红棕色,则D为NO,B为镁条在空气中燃烧的产物之一,其与水反应可生成气体C,C与HCl气体反应生成E时产生大量白烟,则B为Mg3N2,Mg3N2与水反应生成C为NH3,NH3与HCl气体反应生成E为NH4Cl,A为非金属单质,所以A为N2,由C转化为D的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,反应①为氮气与镁反应生成氮化镁,是氧化还原反应,反应②为氮气与氢气合成氨,是氧化还原反应,反应③为氮气与氧气生成一氧化氮,是氧化还原反应,反应④为氮化镁与水发生水解,是非氧化还原反应,反应⑤为氨的催化氧化,是氧化还原反应,反应⑥为氨气与氯化氢生成氯化氨,是非氧化还原反应,所以上述反应中属于氧化还原反应的有,
故答案为:Mg3N2;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;①②③⑤;
(2)C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,将C滴入沸水中可得E的胶体,则D为Fe2O3,C为FeCl3,E为Fe(OH)3,A为生活中常见的金属单质,则A为Fe,B为A与盐酸反应的产物,则B为FeCl2,所以由B转化为C的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,加热蒸干并灼烧FeCl3的溶液可得Fe2O3的原因是FeCl3溶液在加热的条件下充分水解生成氢氧化铁,氢氧化铁在加热的条件下分解得氧化铁,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;FeCl3溶液在加热的条件下充分水解生成氢氧化铁,氢氧化铁在加热的条件下分解得氧化铁.
点评 本题考查元素化合物的推断,为高频考点,题目信息量较大,难度中等,答题时注意根据常见元素化合物的性质和相互转化进行物质推断.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 少量SO2通入NaOH溶液:SO2+OH-═HSO3- | |
| C. | FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{△}{→}$
$\stackrel{△}{→}$
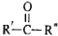 →
→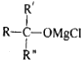 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$


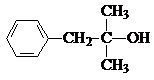


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散系的稳定性,将分散系分为溶液、胶体和浊液 | |
| B. | 根据是否具有丁达尔效应鉴别蛋白质溶液和氯化钠溶液 | |
| C. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,生成Fe(OH)3胶体 | |
| D. | “纳米材料”是粒子直径为1 nm~100 nm的材料,纳米铜是其中的一种,它是胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com