
某温度下,饱和石灰水的溶解度为Sg,密度为ρg/mL,向足量该饱和溶液中加入mgCaO,充分作用后,恢复到原来温度,下列有关说法不正确的是( )
A.最终得到沉淀的质量大于 37m/28g
B.该饱和溶液质量百分比浓度为 s/(100+s)%
C.最终所得溶液PH不变
D.该饱和溶液中溶质物质的量浓度为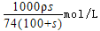
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:填空题
已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式 .
(2)该反应的正反应是 反应(填“放热”或者“吸热”)
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:

①此时系统温度400℃,比较正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中 点.比较图中B、D两点所对应的正反应速率B D(填“>”、“<”或 “=”).理由是 .

(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂
c.压缩容器的体积 d.增加水蒸气的浓度
e.及时分离出产物.
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
下列物质中均含有酸性杂质,除去这些杂质的方法中正确的是
A.乙醇中含乙酸杂质:加入足量氧化钙,蒸馏
B.制氯气时,依次通过饱和NaHCO3溶液和浓硫酸净化气体
C.CO2中混有H2S通过足量的浓硫酸溶液洗气,以得到纯净的CO2
D.通过灼热的镁粉除去N2中的O2
查看答案和解析>>
科目:高中化学 来源:2016届宁夏中卫一中高三上学期期末理综化学试卷(解析版) 题型:推断题
[化学—有机化学基础] (15分)
阿斯巴甜作为强烈甜味剂被广泛应用于食品、饮料、糖果等,工业上可以用苯丙氨酸甲酯和α-氨基丁二酸为原料合成:

已知:RCN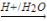 RCOOH;
RCOOH; 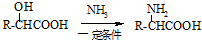
(1)A中含氧官能团的名称为_________________________ ;
(2)①、⑤的反应类型依次为___________、______________;
(3)B的同分异构体中同时符合下列条件的有2种,写出其结构简式______________;
①有三种化学环境不同的氢原子;②含苯环的中性物质
(4)写出阿斯巴甜与足量NaOH水溶液充分反应的化学方程式_________________________;
(5)写出以1,3-丙二醇(HOCH2-CH2-CH2OH)为原料制备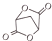 的合成路线流程(无机试剂任选).合成路线流程示例如下
的合成路线流程(无机试剂任选).合成路线流程示例如下 :
:
_______________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上12月月考化学试卷(解析版) 题型:选择题
如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
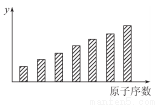
A.y轴表示的可能是基态的原子失去一个电子所需要的最小能量;
B.y轴表示的可能是原子在化合物中吸引电子的能力标度;
C.y轴表示的可能是原子半径;
D.y轴表示的可能是形成基态离子转移的电子数
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:简答题
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_____________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式______________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=______________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。

①升高温度________________;②再通入CO_________________。
(5)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)
__ ___。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
鉴别NaCl、NaBr、NaI可以采用的试剂是( )
A.碘水、淀粉溶液 B.碘化钾淀粉溶液 C.溴水、苯 D.氯水、CCl4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:填空题
(1)KClO3与浓盐酸发生反应:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O,该反应中被氧化的元素和被还原的元素的质量之比为__________。转移1 mol电子时,产生标准状况下的Cl2__________ L。
(2)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O
写出配平的化学方程式________________。生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________。如果向FeBr2 溶液中通入等物质的量的Cl2,该反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上学期12月月考化学试卷(解析版) 题型:填空题
工业电解饱和食盐水模拟装置的结构如图所示:
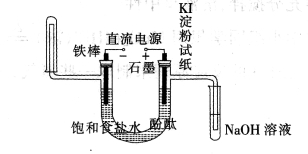
(1)写出电解饱和食盐水的化学方程式 ,该工业称为 工业
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④③①
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式(并用双线桥表示电子的转移的方向和数目) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com