
| A. | 2F2+2H2O═4HF+O2 | B. | 2Al+2H2O+2NaOH═2NaAlO2+3H2↑ | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界无热量交换)密闭容器中进行该反应,化学平衡常数改变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO, 反应达到平衡前的速率:v(正)>v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃和101kp的条件下,4.9L甲烷完全燃烧生成的水的分子数为0.4NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | Na2O2与足量H2O反应生成标况下11.2LO2,转移电子的数目为2 NA | |
| D. | 标准状况下,2.24LHF中所含电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
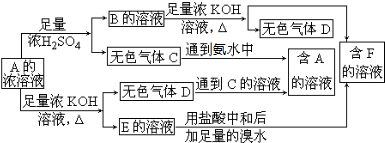
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
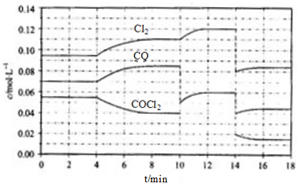 COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):
COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com