
| A、Na2O+H2O=2NaOH | ||||
| B、2F2+2H2O=4HF+O2 | ||||
| C、C+H2O=CO+H2 | ||||
D、2H2O
|
| ||


科目:高中化学 来源: 题型:
| A、1:9 | B、9:1 |
| C、10:1 | D、1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
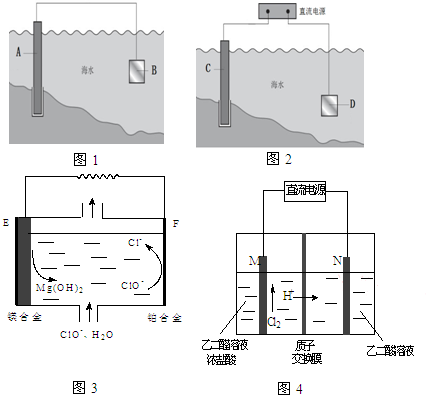 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与乙醇反应时,NH5被氧化 |
| B、NH5中N元素的化合价为+5价 |
| C、1 mol NH5中含有5 molN-H键 |
| D、1 mol NH5与H2O完全反应,转移电子2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、航天飞机上的隔热陶瓷瓦属于优质合金材料 |
| B、将少量CO2通入CaCl2溶液能生成白色沉淀 |
| C、蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进入人体的重金属盐能使蛋白质变性,所以会使人中毒 |
| B、卤代烃C4H8Cl2有四种同分异构体 |
| C、甲烷是天然气的主要成分,能发生加成反应 |
| D、用驴皮熬制成的胶(阿胶)是一种天然橡胶,属于天然高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com