
【题目】氯化钠溶于水形成溶液,若氯化钠分散在酒精中,形成的分散系是( )
A.溶液
B.胶体
C.悬浊液
D.乳浊液
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2![]() +2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,正确的是
+2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,正确的是
A. 干电池中锌筒为正极,石墨棒为负极
B. 干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C. 干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D. 干电池可实现化学能向电能和电能向化学能的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.在溴化铁存在的条件下,苯与溴水发生反应生成褐色的液体溴苯
B.在试管中依次加入一定量的浓硫酸、浓硝酸和苯,然后加热制取硝基苯
C.除去乙烷中混有的少量乙烯的方法是将其通入溴水中
D.等物质的量的甲烷与氯气在光照条件下反应可以得到纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】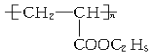 对此聚合物分析正确的是( )
对此聚合物分析正确的是( )
A. 其单体是CH2=CH2和HCOOC2H5
B. 它是缩聚反应产物
C. 其单体是CH2=CH-COOC2H5
D. 其链节是CH3CH2-COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1894年,Fenton发现采用Fe2+和H2O2混合溶液,能产生具有高反应活性和强氧化性的羟基自由基(-OH),从而氧化降解有机污染物,称为Fenton反应。电Fenton法采用惰性电极电解法,右图为其中一个电极的反应机理,其中含有Fenton反应。下列说法不正确的是( )

A. 羟基自由基(-OH)的电子式为:![]()
B. 右图所在的惰性电极应与外接电源的负极相连
C. Fenton反应:Fe2++H2O2==Fe3++OH-+-OH
D. 右图所在的惰性电极每消耗22.4LO2(标准状况),理论上在外电电路中转移4mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe2+、Mg2+、S、I-、H+中只能作氧化剂的是__(用离子符号表示,下同),只能作还原剂的是__,既能作氧化剂又能作还原剂的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体步骤如下:

①包装:取滤纸制成滤纸筒,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作b。
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水,加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h)。
③称量:萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发,待无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作c。
回答下列问题:
(1)实验中三次使用的仪器X的名称为__________________。为提高乙醚蒸气的冷凝效果,索氏提取器可选用下列_______(填字母)代。
![]()
![]()
![]()
a.空气冷凝管 b.直形冷凝管 c.蛇形冷凝管
(2)实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为_______(填字母)。
a.活性炭 b.碱石灰 c.P2O5 d.浓硫酸
无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是______________________________________。
(3)实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是_______。当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提筒中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为_______。索氏提取法与一般萃取法相比较,其优点为___________________________。
(4)数据处理:样品中纯脂肪百分含量_________(填“<”、“>”或“=”)(b-c)/(b-a)×100%;测定中的样品、装置、乙醚都需要进行脱水处理,否则导致测定结果__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素分别转化为氢氧化物沉淀而分离开来。

已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:

(1)工业上用固体A作原料制取水玻璃的化学方程式为_________。
(2)固体E的化学式为_________。
(3)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_______。
(4)上述流程中的试剂Y最好选用下列中的_______(选填字母编号)。
A.水 B.硫酸 C.氨水 D.氢氧化钠
(5)写出反应F→H的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g质量分数为46%的乙醇水溶液中含有氧原子数为4NA
B. 若将1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C. 向大量水中通入1 mol氯气,反应中转移的电子数为NA
D. 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com