
充分燃烧某糖,消耗的O2、生成的CO2和H2O的物质的量都相等,它的相对分子质量是它最简式式量的6倍,0.1 mol 该糖能还原银氨溶液生成21.6 g银,0.1 mol该糖能与30 g乙酸发生酯化反应。求该糖的:
(1)最简式。
(2)相对分子质量、分子式。
(3)若该糖是直链分子,已知同一个碳原子上连有2个—OH不稳定,试推导其结构简式。
(1)CH2O (2)180,C6H12O6
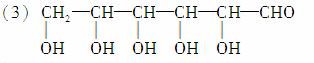
解析 (1)依题意可知,该糖分子内C、H、O三种原子的物质的量之比为:1∶2∶(2+1-2)=1∶2∶1,故该糖的最简式为CH2O。
(2)由最简式可得最简式式量为30,依题意,该糖的相对分子质量为6×30=180,分子式为(CH2O)6即C6H12O6。
(3)设该糖分子中含有x个—CHO,y个—OH。
R(CHO)x~2xAg
1 2x
0.1 21.6/108
解得x=1
R(OH)y ~ yCH3COOH
1 y
0.1 30/60
解得y=5
由于该糖为直链分子,且由于多个—OH连在同一碳原子上不稳定,故该糖的结构简式为:
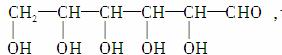 该糖的结构为五羟基醛,为葡萄糖。
该糖的结构为五羟基醛,为葡萄糖。


科目:高中化学 来源: 题型:
奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相 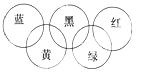
连环物质间一定条件下能发生常见反应,不相连环物质间不能发生 反应,且四种反应中必须包含化合反应、置换反应及复分解反应, 适合的一组是( )
| 蓝 | 黄 | 黑 | 绿 | 红 | |
| A | SiO2 | NaOH溶液 | CuSO4溶液 | Ag | O2 |
| B | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
| C | O2 | NH3 | 稀H2SO4 | NaOH溶液 | Al(OH)3 |
| D | Mg | Al | CO2 | Fe2O3 | KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程: 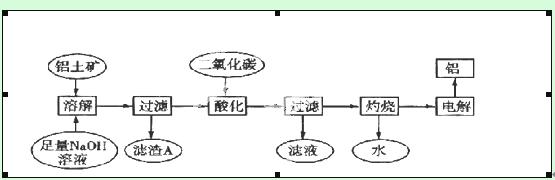
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为: 2Na2SiO3+2NaAlO2+4H2O===Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:____________。
(2)滤渣A的主要成分________;硅铝酸盐沉淀写成氧化物的形式是________。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是_____________
(4)若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
(5)若将铝溶解,下列试剂中最好选用_______(填编号)。
A.浓硫酸 B. 稀硫酸 C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是____,配位数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
酒精、乙酸和葡萄糖三种溶液,只用一种试剂就能将它们区别开来,该试剂是( )
A.金属钠 B.石蕊试液
C.新制的氢氧化铜悬浊液 D.NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
.现有A、B、C、D四种短周期元素,它们之间的关系如下:
Ⅰ.原子半径:A < C < B < D Ⅱ.原子的最外层电子数:A + C = B + D = 8
Ⅲ.原子的核外电子层数:B = C = 2A Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)由A、B两种元素组成的常见气体,其电子式为 ;只有A和B两种元素组成的属于离子晶体的化合物可能为 (用化学式表示)。
(2)由D元素形成的氢氧化物,与强碱溶液反应的离子方程式为 。
(3)由B、C元素组成的化合物BC3,该化合物具有强氧化性,与水反应生成两种酸和一种无色气体,该气体常温下遇空气变红棕色,写出该化合物与水反应的化学方程式 。
(4)由A、B和C三种元素组成的盐,常温下其水溶液显酸性,则0.1 mol·L-1 该盐溶液中浓度最大的离子为 (写离子符号);写出检验该盐中所含阳离子的实验方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质熔点的排列顺序,不正确的是 ( )。
A.HI>HBr>HCl>HF B.CI4>CBr4>CCl4>CF4
C.NaCl>NaBr>KBr D.金刚石>碳化硅>晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO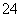 )>c(NH
)>c(NH )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com