
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结构示意图为 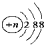 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| B. | 球棍模型为  的分子可发生加成反应 的分子可发生加成反应 | |
| C. | 邻硝基甲苯的结构简式为 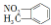 ,能发生取代反应 ,能发生取代反应 | |
| D. | 电子式分别为  和 和 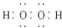 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mol•(L•min)-1 | B. | 0.1mol•(L•s)-1 | C. | 0.2mol•(L•s)-1 | D. | 0.4mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaHCO3、NaCl、NH4Cl | B. | Na2CO3、NaHCO3、NH4Cl、NaCl | ||
| C. | NH4Cl、(NH4)2SO4、Na2S、NaNO3 | D. | (NH4)2SO4、NH4Cl、NaNO3、Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
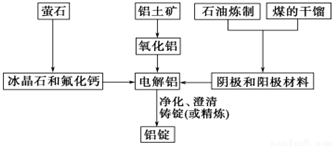
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠和过量的澄清石灰水反应 2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32- | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com