
分析 (1)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,根据平衡移动原理结合选项分析解答,注意不能增大氯气的用量;
(2)氯化银的溶解度远远小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀;
(3)SO2Cl2遇水生成硫酸和氯化氢,根据原子守恒书写;
(4)发生反应SO2Cl2+2H2O═H2SO4+2HCl,H2SO4+BaCl2═BaSO4↓+2HCl,根据n=$\frac{m}{M}$计算SO2Cl2的物质的量,由SO2Cl2的物质的量计算最终溶液中氢离子的浓度,据此计算pH.
解答 解:(1)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,不能增大氯气的用量,
A.缩小容器体积,压强增大,平衡向正反应移动,Cl2的转化率增大,故A正确;
B.使用催化剂,缩短到达平衡的时间,不影响平衡移动,Cl2的转化率不变,故B错误;
C.增加SO2浓度,平衡向正反应移动,Cl2的转化率增大,故C正确;
D.该反应正反应是放热反应,升高温度,平衡向逆反应移动,Cl2的转化率降低,故D错误;
故答案为:AC;
(2)氯化银的溶解度远远小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,
故答案为:AgCl;
(3)SO2Cl2遇水生成硫酸和氯化氢,则其水解方程式为:SO2Cl2+2H2O═H2SO4+2HCl,故答案为:SO2Cl2+2H2O═H2SO4+2HCl;
(4)发生反应SO2Cl2+2H2O═H2SO4+2HCl,SO2Cl2的物质的量为$\frac{33.75g}{135g/mol}$=0.25mol,由SO2Cl2+2H2O═H2SO4+2HCl可得生成n(H2SO4)=0.25mol,生成n(HCl)=0.5mol,又H2SO4+BaCl2═BaSO4↓+2HCl,所以硫酸又转化成HCl,又生成n(HCl)=0.5mol,故所得虑液中含HCl为1mol,氢离子浓度为$\frac{1moL}{1L}$=1mol/L,则pH=0,故答案为:0.
点评 本题考查化学平衡的影响因素、沉淀转化、化学计算等,难度中等,(4)中计算注意根据方程式进行计算.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
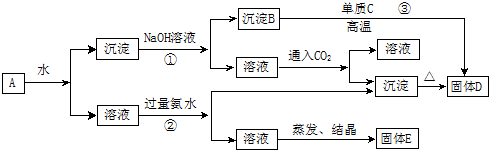
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯的结构简式: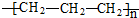 | B. | 丙烷分子的比例模型: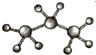 | ||
| C. | 四氯化碳分子的电子式: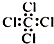 | D. | 2-乙基-1,3-丁二烯分子的键线式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
 和
和

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 2:6:3 | C. | 3:6:2 | D. | 2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B |
| C | D |
| A. | 原子半径:C>A=D>B | |
| B. | 最高价氧化物对应的水化物酸性:B>D | |
| C. | 气态氢化物的稳定性:C>D>B | |
| D. | C的气态氢化物的水溶液在空气中放置会出现浑浊现象,可以说明非金属性A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
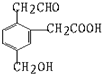 某有机物的结构式为它在一定条件下(如图)能发生的反应有( )
某有机物的结构式为它在一定条件下(如图)能发生的反应有( )| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com