
| A、离子化合物可能含有共价键 | B、常温下的气体分子中一定都含有共价键 | C、共价化合物中可能含有离子键 | D、非极性分子中一定都含有非极性键 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、亚硝酸钠外观与食盐相似,亚硝酸钠和食盐一样也具有咸味 | B、食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂 | C、亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀 | D、某钠盐溶液中可能含有SO42-、SO32-、CO32-、NO2-,加足量BaCl2溶液,产生白色沉淀,再加稀硝酸沉淀溶解且放出有色刺激性气体,该溶液中肯定有NO2-肯定没有SO42-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
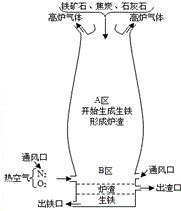 钢铁工业是国家工业的基础.下图是炼铁高炉及炉内化学变化过程示意图,根据图示回答下列问题.若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式.
钢铁工业是国家工业的基础.下图是炼铁高炉及炉内化学变化过程示意图,根据图示回答下列问题.若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾既可以除去水中的悬浮物,也可以杀菌消毒 | B、可以通过电解明矾溶液来制取Al | C、用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高 | D、可以用在某溶液中加入盐酸酸化的氯化钡溶液的方法来确定该溶液中是否含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池板中有高纯硅单质,光导纤维的主要成分也是硅 | B、分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | C、核磁共振谱、红外光谱、紫外光谱和质谱法的综合运用,可用于分析有机物的结构 | D、绿色荧光蛋白在研究癌症发病机制的过程中应用突出,在酸性或碱性条件下可能会失去发光功能 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:实验题
(16分) 硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
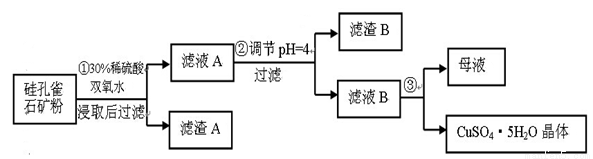
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A. CuO B.Fe2O3 C.Al2O3 D.Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(4)将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com