考点:化学平衡的影响因素,氧化还原反应方程式的配平,化学电源新型电池,转化率随温度、压强的变化曲线
专题:基本概念与基本理论
分析:I.该反应中氧化过程为CuS→SO
2,CuS作还原剂,要使该反应发生,需要氧化剂,酸性条件下KMnO
4具有强氧化性,所以可以作氧化剂,则MnSO
4为还原产物,溶液呈酸性,硫酸是反应物,水是生成物,据此书写方程式;
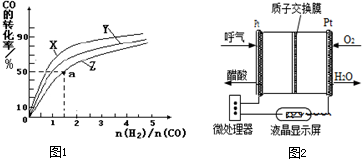
II.(1)该可逆反应是反应前后气体体积减小的放热反应,增大反应速率又有利于提高CO转化率,应该增大压强;
(2)该反应的正反应是放热反应,升高温度平衡向逆反应方向移动,则CO的转化率降低,所以Z表示最高温度下的反应;
a点时,n(H
2)/n(CO)=1.5,反应开始时n(CO)=2mol,则开始时n(H
2)=3mol,CO的转化率为50%,平衡时n(CO)=2mol×(1-50%)=1mol,n(H
2)=3mol-2×(2mol×50%)=2mol,n(CH
3OH)=1mol,平衡时混合气体的物质的量=1mol+2mol+1mol=4mol,混合气体质量=2mol×28g/mol+3mol×2g/mol=62g,根据M=
计算其平均相对分子质量;
(3)该电池为燃料电池,交换膜为质子交换膜,说明溶液呈酸性,则负极上乙醇失电子发生氧化反应生成乙酸,正极上氧气得电子和氢离子反应生成水.
解答:
解:I.该反应中氧化过程为CuS→SO
2,CuS作还原剂,要使该反应发生,需要氧化剂,酸性条件下KMnO
4具有强氧化性,所以可以作氧化剂,则MnSO
4为还原产物,溶液呈酸性,硫酸是反应物,水是生成物,根据转移电子相等、原子守恒配平方程式为6KMnO
4+5CuS+14H
2SO
4=3K
2SO
4+6MnSO
4+5CuSO
4+5SO
2↑+14H
2O,
故答案为:6KMnO
4+5CuS+14H
2SO
4=3K
2SO
4+6MnSO
4+5CuSO
4+5SO
2↑+14H
2O;
II.(1)该可逆反应是反应前后气体体积减小的放热反应,
A.随时将CH
3OH与反应混合物分离,平衡向正反应方向移动,但反应速率不变,故错误;
B.降低反应温度平衡向正反应方向移动,但反应速率减小,故错误;
C.增大体系压强,平衡向正反应方向移动且反应速率增大,故正确;
D.使用高效催化剂,反应速率增大,但平衡不移动,故错误;
故选C;
(2)该反应的正反应是放热反应,升高温度平衡向逆反应方向移动,则CO的转化率降低,所以Z表示最高温度 270℃下的反应;
a点时,n(H
2)/n(CO)=1.5,反应开始时n(CO)=2mol,则开始时n(H
2)=3mol,CO的转化率为50%,平衡时n(CO)=2mol×(1-50%)=1mol,n(H
2)=3mol-2×(2mol×50%)=2mol,n(CH
3OH)=1mol,平衡时混合气体的物质的量=1mol+2mol+1mol=4mol,混合气体质量=2mol×28g/mol+3mol×2g/mol=62g,根据M=
得混合气体平均摩尔质量=
=15.5g/mol,气体的摩尔质量在数值上等于其相对分子质量,所以该混合气体的平均相对分子质量为15.50,
故答案为:270℃;15.50;
(3)该电池为燃料电池,交换膜为质子交换膜,说明溶液呈酸性,则负极上乙醇失电子发生氧化反应生成乙酸,电极反应式为CH
3CH
2OH+H
2O-4e
-=CH
3COOH+4H
+,正极上氧气得电子和氢离子反应生成水,电极反应式为O
2+4H
++4e
-=2H
2O,
故答案为:CH
3CH
2OH+H
2O-4e
-=CH
3COOH+4H
+.
点评:本题考查较综合,涉及原电池原理、化学平衡计算、外界条件对化学平衡的影响、氧化还原反应等知识点,侧重考查学生分析问题、灵活运用知识解答问题能力,知道(1)中氧化剂的确定方法,了解常见的氧化剂、还原剂,题目难度中等.



 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案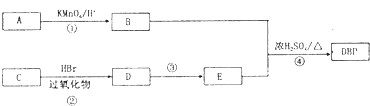 增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示: