
����Ŀ����ͼ��ʾ�����Թܷ���ʢ��25��ı���ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���5mL�������Թ��У��Իش����лش� 
��1��ʵ���й۲쵽�������� ��
A.�Թ���þƬ���ܽ�
B.�Թ��в�����ɫ����
C.�ձ���ڱ���
D.�ձ��ײ�����������ɫ����
��2���Թ��з����ķ�Ӧ������ѡ�������ԭ��Ӧ����������ԭ��Ӧ������
��3��д���йط�Ӧ�����ӷ���ʽ ��
��4����ʵ����֪��MgCl2��Һ��H2��������������ڡ���С�ڡ������ڡ���þƬ���������������
���𰸡�
��1��ABD
��2��������ԭ��Ӧ
��3��Mg+2H+=Mg2++H2��
��4����
���������⣺��1��Mgλ����֮ǰ���ܺ�ϡ���ᷴӦ�����������÷�Ӧ�Ƿ��ȷ�Ӧ���ų�������ʹ�ձ�����Һ�¶����ߣ����������ܽ�������¶����߶���С��A��þ��ϡ���ᷴӦ�����Ȼ�þ�������������Թ���þƬ���ܽ⣬����ȷ��B�����������������Թ��в�����ɫ���ݣ�����ȷ��C����������ķ�Ӧ�Ƿ��ȷ�Ӧ�������ձ���ڱ��ȣ��ʴ���D�����������ܽ�������¶����߶���С�������¶ȣ��������Ʊ�����Һ��Ϊ��������Һ�������ձ��ײ�����������ɫ���壬����ȷ����ѡABD����2�����������ӷ�ӦΪMg+2H+=Mg2++H2�����÷�Ӧ���е���ת�ƣ���������������ԭ��Ӧ���ʴ�Ϊ��������ԭ��Ӧ����3�����ʡ����塢������д��ѧʽ��������ǿ�����д���ӣ����ӷ���ʽΪMg+2H+=Mg2++H2�����ʴ�ΪMg+2H+=Mg2++H2������4�����ȷ�Ӧ�з�Ӧ���������������������������÷�Ӧ�Ƿ��ȷ�Ӧ������MgCl2��Һ��H2��������С��þƬ����������������ʴ�Ϊ��С�ڣ�
��1��Mgλ����֮ǰ���ܺ�ϡ���ᷴӦ�����������÷�Ӧ�Ƿ��ȷ�Ӧ���ų�������ʹ�ձ�����Һ�¶����ߣ����������ܽ�������¶����߶���С����2���е���ת�ƵĻ�ѧ��Ӧ��������ԭ��Ӧ����3�����ʡ����塢������д��ѧʽ��������ǿ�����д���ӣ���4�����ȷ�Ӧ�з�Ӧ��������������������������


 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʹ��������ƽ������������ȷ����
A. ����ǰ�ȵ���������ƽ�����
B. ����ʱ���̷ű���������̷�����
C. ��ʪ�Ļ���и�ʴ�Ե�ҩƷ��������ڲ����������������������ҩƷ��ֱ�ӷ�����ƽ�����ϳ���
D. ��������ƽ����ȷ������0.1 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ṥҵ�����У�Ϊ��������SO2��ת�������ܳ���������ܣ��������м����Ƚ������ĽӴ��ң�����ͼ��������˵���������
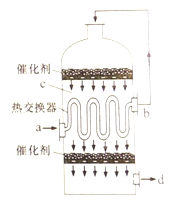
A. a��b�����Ļ������ɷֺ�����ͬ���¶Ȳ�ͬ
B. c��d�����Ļ������ɷֺ�����ͬ���¶Ȳ�ͬ
C. �Ƚ�������������Ԥ�ȴ���Ӧ�����壬��ȴ��Ӧ�������
D. c�����徭�Ƚ������ٴδ�������Ŀ�������SO2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԼ��顢��ϩ���ʵ������У�����ȷ����( )
A.��ϩ��ʹ��ˮ��ɫ
B.��һ�������£���ϩ�����Ӿ����ɾ���ϩ
C.������ʹ���Ը��������Һ��ɫ
D.�ڹ��������£���������������ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. �ȼҵ�е�ⱥ��ʳ��ˮ��2Cl��+2H2O![]() H2��+Cl2��+2OH��
H2��+Cl2��+2OH��
B. �Ȼ�����Һ��ʴͭ�壺Fe3++Cu=Fe2++Cu2+
C. ����������Һ����������������SO2+OH��=HSO3��
D. ϡ�����м�����������Һ�����ԣ�Ba2++H++OH��+SO42��=BaSO4��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ���ǣ� ��
ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
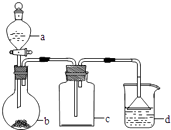
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ĺ�ҵ�Ʒ��У���ȷ���ǣ� ��
A.���ƣ��ú�ˮΪԭ���Ƶþ��Σ��ٵ�ⴿ����NaCl��Һ
B.������������ʯΪԭ�ϣ�CO��ԭ����
C.��þ���ú�ˮΪԭ�ϣ���һϵ�й����Ƶ�����þ���壬H2��ԭ��þ
D.���������������л���������ٵõ��Ȼ������壬������ڵ��Ȼ����õ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ����(��H�ľ���ֵ����ȷ) �� ��
A. C2H5OH(l)��3O2(g)=2CO2(g)��3H2O(g) ��H��-1 367.0 kJ��mol��1(ȼ����)
B. NaOH(aq)��HI(aq)=NaI(aq)��H2O(l) ��H��-57.3 kJ��mol��1(���)
C. S(s)��![]() O2(g)=SO3(g) ��H��-296.8 kJ��mol��1(ȼ����)
O2(g)=SO3(g) ��H��-296.8 kJ��mol��1(ȼ����)
D. 2NO2=O2��2NO ��H����116.2 kJ��mol��1(��Ӧ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijһ��������ɱ���ܱ������з������·�Ӧ��A(g)+B(g)![]() 2C(g) ��H<0��ijʱ�̴ﵽƽ�����
2C(g) ��H<0��ijʱ�̴ﵽƽ�����![]() ʱ�̸ı�ijһ�������䷴Ӧ������ͼ��ʾ������˵����ȷ����( )
ʱ�̸ı�ijһ�������䷴Ӧ������ͼ��ʾ������˵����ȷ����( )

A. ![]()
B. I���������̴ﵽƽ��ʱ��A���������I>II
C. ![]() ʱ�̸ı�����������ܱ������м�C
ʱ�̸ı�����������ܱ������м�C
D. I��II�����̴ﵽƽ��ʱ��ƽ�ⳣ��I<II
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com