
| A. | 加入少量NaOH固体后溶液pH小于9 | |
| B. | 加水稀释,CH3COONa水解程度增大,c(OH-)增大 | |
| C. | 该溶液水电离出的c(OH-)═10-9 | |
| D. | CH3COOH在常温下Ka数值约为1×10-5 |
分析 A、加入NaOH固体后c(OH-)增大;
B、盐溶液越稀越水解;
C、在盐溶液中,氢氧根和氢离子全部来自于水的电离;
D、醋酸平衡常数Ka需要根据醋酸钠的水解平衡常数计算.
解答 解:A、加入NaOH固体后c(OH-)增大,则pH变大,即大于9,故A错误;
B、盐溶液越稀越水解,故加水稀释,CH3COONa水解程度增大,但由于溶液体积增大,故c(OH-)减小,故B错误;
C、在盐溶液中,氢氧根和氢离子全部来自于水的电离,但由于CH3COO-将水电离出的氢离子结合,故溶液中的氢氧根是水电离出的全部,而pH=9时,溶液中的c(OH-)═10-5,即水电离出的c(OH-)═10-5,故C错误;
D、醋酸平衡常数Ka需要水解平衡常数计算,CH3COO-+H2O?CH3COOH+OH-,Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH)•{K}_{w}}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-5}×1{0}^{-5}}{0.1}$,故解得Ka=10-5,故D正确;故选D.
点评 本题考查了盐类水解的分析判断,弱电解质电离平衡常数的计算应用和影响水解平衡的因素分析,掌握基础是关键,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;
2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
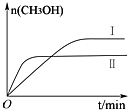 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl- | |
| B. | 常温下由水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3- | |
| C. | 有Fe3+存在的溶液中:CO32-、NH4+、SO42-、Cl- | |
| D. | 在能使石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L H2 | B. | 含3.01×1023 个分子的Cl2 | ||
| C. | 10g NH3 | D. | 0.8 mol SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列说法不正确的是( )
.下列说法不正确的是( )| A. | 上述反应属于取代反应 | |
| B. | 对三联苯分子中至少有16个原子共平面 | |
| C. | 对三联苯的一氯取代物有5种 | |
| D. | 1mol对三联苯在足量的氧气中完全燃烧消耗21.5molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuSO4 | B. | CH3CH2OH | C. | Na2SO4 | D. | NH4CI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com