
分析 (1)铝属于主族元素;
(2)铝是13号元素,核外电子有13个,每一个电子的运动状态都不同,核外电子排布式为1s22s22p63s23p1 ;
(3)电子排布式中能层数与周期数相等,外围电子排布式为(n-1)d10ns1的原子位于第IB族;ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区.
解答 解:(1)铝位于第三周期第ⅢA族,属于主族元素,金、银、铜、铁、和钛都不属于主族元素,故答案为:铝;
(2)铝是13号元素,核外电子有13个,每一个电子的运动状态都不同,核外电子排布式为1s22s22p63s23p1 ,有5个能极,
故答案为:13;5;
(3)电子排布式中最大能层数与周期数相等,外围电子排布式为(n-1)d10ns1的原子位于第IB族,基态金原子的外围电子排布式为5d106s1,该原子最大能层数是6,所以金原子位于第6周期第ⅠB族,ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区,Ag与金位于同一族,属于第ⅠB族,所以属于ds区,
故答案为:6;ⅠB;ds.
点评 本题考查了元素周期表的有关知识,明确元素周期表的结构是解本题关键,了解元素周期表5区的划分方法,难度不大.


科目:高中化学 来源: 题型:解答题

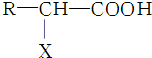 ,X的名称为氨基.
,X的名称为氨基. )易水解,其水解反应的产物为乙酸和
)易水解,其水解反应的产物为乙酸和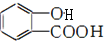 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
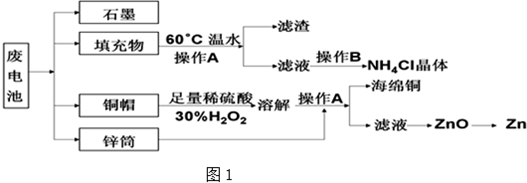
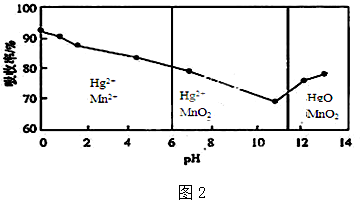
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
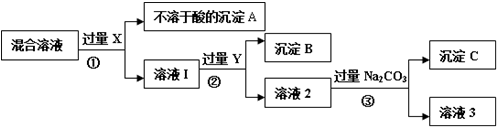
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
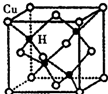 (1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
(1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.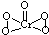 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
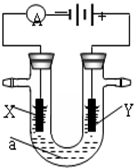 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
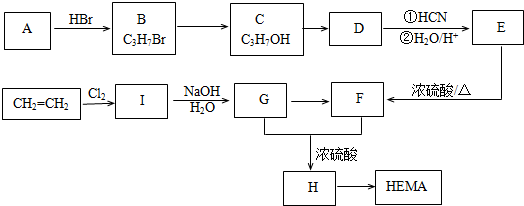
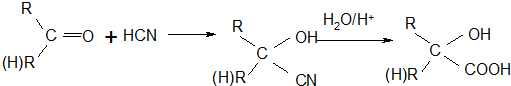
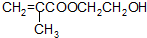 的名称为甲基丙烯酸羟乙酯,
的名称为甲基丙烯酸羟乙酯,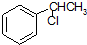 为原料制备
为原料制备 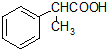 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).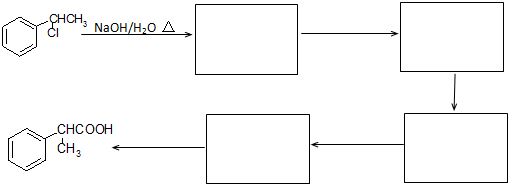
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com