
| A、熔融的NaCl |
| B、KNO3溶液 |
| C、干冰 |
| D、金属铝 |
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
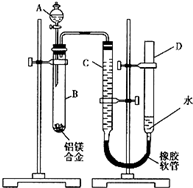 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:| 足量的NaOH溶液 |
| 足量盐酸 |
| () |
| () |
查看答案和解析>>
科目:高中化学 来源: 题型:
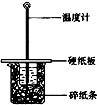 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是固定小烧杯 |
| D、若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液漏斗分离醋酸和水的混合物 |
| B、用酒精萃取碘水中的碘 |
| C、用10mL量筒量取7.5mL稀盐酸 |
| D、用容量瓶配置溶液过程中定容时发现蒸馏水稍微过量,可用胶头滴管吸出少许 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图:a、b、c、d均为铂电极,供选择的四组电解液如下:
如图:a、b、c、d均为铂电极,供选择的四组电解液如下:| 组 | A | B | C | D |
| 甲槽 | NaOH | AgNO3 | H2SO4 | NaCl |
| 乙槽 | CuSO4 | CuCl2 | AgNO3 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示:
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:
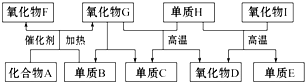
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若溶液中c(OH-)=10-7 mol/L,则该溶液一定呈中性 |
| B、c(H+)越大,则pH越大,溶液的碱性越强 |
| C、pH=0的溶液,其中只含有H+,而无OH- |
| D、向25℃纯水中加少量NaHSO4(温度不变),c(H+)、c(OH-)乘积不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com