
| A、pH=7的溶液 |
| B、c(H+)=c(OH-)的溶液 |
| C、滴加酚酞,颜色未变红的溶液 |
| D、酸与碱恰好完全反应生成正盐的溶液 |


科目:高中化学 来源: 题型:
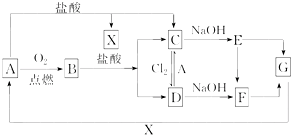 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.
已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3是反应的还原剂 |
| B、此反应中3mol Na2O2转移电子数3mol |
| C、Na2FeO4反应的氧化产物 |
| D、Na2FeO4能消毒杀菌是因其具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢铵溶液与足量氢氧化钠溶液反应并加热NH4++OH-═NH3↑+H2O |
| B、氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
| C、Fe2O3固体溶于过量氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O |
| D、苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1.12L的SO3所含的原子数约为0.2×6.02×1023 |
| B、1mol MgCl2中含有的离子数约为2×6.02×1023 |
| C、1.8g的NH4+离子中含有的电子数约为6.02×1023 |
| D、2.4g金属镁变为镁离子时失去的电子数约为0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、具有抗氧化作用 |
| B、可吸收食品盒内的O2和N2 |
| C、发挥作用时利用了原电池原理 |
| D、变为红褐色后失效 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小CO的浓度 |
| B、增大碳的质量 |
| C、通入He气 |
| D、增大CO2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2 |
| B、ClO2 |
| C、O3 |
| D、H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com