
| A. | W 与Y 可以形成离子化合物 | |
| B. | X 的简单氢化物在同主族元素的氢化物中沸点最高,说明X 的非金属性最强 | |
| C. | X 和Z 形成的原子个数l:1 的化合物中,既含有极性键又含有非极性键 | |
| D. | 工业生产中,通常用电解Z 的熔融氧化物来制取Z 的单质 |
分析 W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、6、8、8,则W是H元素,X是O元素,Y、Z处于第三周期,四元素原子的最外层电子数之和为10,Y、Z最外层电子数之和是10-1-6=3,最外层电子数只能为1、2,又Y原子序数小于Z,则Y是Na元素、Z是Mg元素,据此解答.
解答 解:W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、6、8、8,则W是H元素,X是O元素,Y、Z处于第三周期,四元素原子的最外层电子数之和为10,Y、Z最外层电子数之和是10-1-6=3,最外层电子数只能为1、2,又Y原子序数小于Z,则Y是Na元素、Z是Mg元素.
A.W与Y可以形成NaH,属于离子化合物,故A正确;
B.X的简单氢化物在同主族元素的氢化物中沸点最高,是由于水分子之间存在氢键,故B错误;
C.X和Z形成的原子个数1:1的化合物为MgO,只含有离子键,故C错误;
D.工业上,通常电解熔融氯化镁冶炼镁,故D错误,
故选A.
点评 本题考查原子结构和元素性质,正确判断元素是解本题关键,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
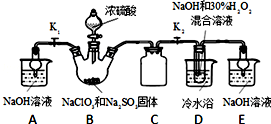
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (该类结构简式为键线式,又如:CH3CH=CHCH2Cl的键线式可写为
(该类结构简式为键线式,又如:CH3CH=CHCH2Cl的键线式可写为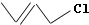 ).根据你所学知识判断,合成碳纤维R的单体最有可能的是( )
).根据你所学知识判断,合成碳纤维R的单体最有可能的是( )| A. | CH2=CH2和N2 | B. | CH3-C≡C-NH2 | C. | HC≡C-C≡N | D. | CH2=CH-CH=NH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 0.1mol/L | C. | 0.001mol/L | D. | 10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 在分液漏斗中用酒精萃取碘水中的碘,分液时下层液体从下口放出,上层液体从上口倒出 | |
| C. | 配制浓H2SO4和浓HNO3的混酸时,应将浓H2SO4慢慢加到浓HNO3中,并及时搅拌 | |
| D. | 用蒸发结晶的方法可使NaCl从溶液中析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| B. | 6.4gS6与S8的混合物中所含S原子数一定为0.4NA | |
| C. | 标准状况下,22.4L苯中含NA个分子 | |
| D. | 1molH2SO4中所含的粒子数目一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400ml | B. | 450ml | C. | 500ml | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com