
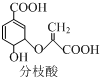
 ,下列关于分枝酸的说法不正确的是( )
,下列关于分枝酸的说法不正确的是( )| A. | 分子中含有3种含氧官能团 | |
| B. | 1 mol分枝酸最多可与3mol NaOH发生中和反应 | |
| C. | 在一定条件下可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,但褪色原理不同 |
分析 该有机物中含有碳碳双键、醇羟基、醚键、羧基,具有烯烃、酚、醚和羧酸性质,能发生加成反应、加聚反应、氧化反应、取代反应等,据此分析解答.
解答 解:A.该物质中含有碳碳双键、醇羟基、醚键和羧基四种官能团,但含有3种含氧官能团,故A正确;
B.不是苯环,只有-COOH与NaOH反应,则1mol分枝酸最多可与2molNaOH发生中和反应,故B错误;
C.含-COOH与乙醇发生酯化反应,含-OH与乙酸发生酯化反应,故C正确;
D.碳碳双键与溴的四氯化碳溶液发生加成反应,双键与-OH均能被酸性高锰酸钾溶液氧化,原理不同,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意该分子中没有酚羟基,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol•L?1的NaCl溶液中所含Na+为NA个 | |
| B. | 标准状况下,11.2 L SO3所含的分子数为0.5NA | |
| C. | 0.1 mol CH4所含的电子数为1NA | |
| D. | 2molNO和1mol O2混合,所得气体分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
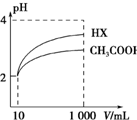 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:| 弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48gO3中所含的氧原子数为3NA | |
| B. | 1.8gNH4+中所含质子数为0.1NA | |
| C. | 标况下,11.2L氧气中所含原子数为0.5NA | |
| D. | 2.4g金属镁变成离子时得到的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子数:17gOH-与1mol-OH | |
| B. | 双键数目:1mol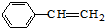 与4mol C2H4 与4mol C2H4 | |
| C. | 分子数:常温常压下16g氧气与4g氦气 | |
| D. | 阴离子总数:72gCaO2与62g Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4•5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com