
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是
)。下列说法错误的是
A. 肉桂醛能发生加成反应、取代反应和加聚反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛的芳香族同分异构体中能发生银镜反应的有3种
D. 苯甲醛分子中所有原子可能位于同一平面内
【答案】C
【解析】A. 肉桂醛分子中有苯环、碳碳双键和醛基,所以其能发生加成反应、取代反应和加聚反应,A正确;B. 含有醛基的物质与新制的氢氧化铜共热可以生成砖红色沉淀,故可用新制氢氧化铜悬浊液检验肉桂醛分子中的醛基,B正确;C. 肉桂醛的芳香族同分异构体中能发生银镜反应的,分子中一定有醛基,若苯环上有醛基和乙烯基两个取代基,这两个取代基在苯环上有3种排列方式;若苯环只有一个取代基,则该取代基为-C(CHO)=CH2。故符合条件的同分异构体共有4种,C不正确;D. 由苯环的12原子共面、甲醛分子中所以原子共面、单键可以旋转可知,苯甲醛分子中所有原子可能位于同一平面内,D正确。本题选C.


科目:高中化学 来源: 题型:
【题目】下列有机物的结构简式中,书写正确的是( )
A. CH2CH2 B. C2H5OOCCH3 C. CH3—CH—CH3 D. CH3C—OOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对炼锌厂的铜镉废渣中各元素进行分离,能减少环境污染,同时制得食品锌强化剂的原料ZnSO4·7H2O实现资源的再利用。其流程图如下。

[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO![]() 。
。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高铜镉废渣浸出率可以采用的方法是(写出其中一点即可)____;
(2)向滤液I中逐滴滴人酸性KMnO4溶液可与AsO![]() 发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____;
(4)上述流程除了实现对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用,还可以得到副产物___
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池的工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的正极反应式为____;
(6)若a克铜镉废渣含有b molFe元素,加入了c mol KMnO4,则铜镉废渣中As元素的质量分数为____。(不考虑镉元素与KMnO4的反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)25℃时,在0.1L 0.2molL﹣1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= .
(2)25℃时,若向0.1mol/L氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42﹣)= .
(3)室温下,若向0.1mol/L氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是 .
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×l0﹣7、K2=5.6×10﹣11 |
回答下列问题
25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为 .
向NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为: .
(5)常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O==Cu2O+2Ag,下列有关说法正确的是( )
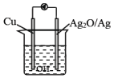
A. 测量原理示意图中,电子方向从Ag2O→Cu
B. 反应中有0.5 NA个电子转移时,析出0.5mol Cu2O
C. 正极的电极反应为Ag2O+2e- + H2O==2Ag+2OH-
D. 电池工作时,OH-离子浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律和周期表的描述,正确的是( )
A. 在元素周期表的右上方可以寻找制取半导体的元素
B. 元素的性质随着原子序数的增加而呈周期性变化
C. 俄国化学家门捷列夫是通过实验的方法建立元素周期表的
D. 同一主族元素的原子从上到下,原子半径减小,金属性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A可实现氯的循环利用.反应A:4HCl+O2 ![]() 2Cl2+2H2O 已知:ⅰ.此条件下反应A中,4mol HCl被氧化,放出115.6kJ的热量.
2Cl2+2H2O 已知:ⅰ.此条件下反应A中,4mol HCl被氧化,放出115.6kJ的热量.
ⅱ. ![]()
①写出此条件下,反应A的热化学方程式 .
②断开1mol H﹣O键与断开1mol H﹣Cl键所需能量相差约为kJ.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com