
分析 (1)①反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平;
②K2MnO4加硫酸酸化后,K2MnO4转变为MnO2和KMnO4,根据化合价升降相等与电荷守恒配平;
(2)①HCl具有还原性,能被酸性高锰酸钾溶液氧化;
②高锰酸钾溶液具有强氧化性能氧化橡胶管,滴入最后一滴溶液变为紫红色且半分钟不褪色证明反应达到终点;
③利用有关反应的方程式可以得出关系式:5Ca2+~2KMnO4,据此计算.
解答 解:(1)①由软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为-1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平方程式为:3MnO2+6KOH+KClO3 $\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O,
故答案为:3MnO2+6KOH+KClO3 $\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O;
②由滤液酸化后,K2MnO4转变为MnO2和KMnO4,反应中只有Mn元素化合价变化,Mn元素部分由+6价降低为+4,部分升高为+7,根据化合价升降相等,则二氧化锰与高锰酸钾的物质的量之比为1:2,再根据电荷守恒、原子守恒配平方程式为:3MnO42-+4H+═MnO2↓+2MnO4-+2H2O,
故答案为:3MnO42-+4H+═MnO2↓+2MnO4-+2H2O;
(2)①HCl具有还原性,能被酸性高锰酸钾溶液氧化而造成误差,所以不能用盐酸代替,
故答案为:不能;因为高锰酸钾与浓盐酸反应,KMnO4能氧化Cl- 消耗高锰酸钾;
②高锰酸钾溶液具有强氧化性能氧化橡胶管,滴入最后一滴溶液变为紫红色且半分钟不褪色证明反应达到终点,
故答案为:酸; 当滴下最后一滴KMnO4溶液,溶液由无色变浅红色,且半分钟内不变色;
③由CaC2O4+H2SO4═CaSO4+H2C2O4、2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O可以得出关系式:
5Ca2+~5CaC2O4~5H2C2O4~2KMnO4
5 2
n=5×10-6mol 1.0×10-4mol×0.02L=2×10-6mol
M(Ca2+)=5×10-6mol×$\frac{200}{2}$×40g/mol=0.02g,
故答案为:0.02.
点评 本题考查化学反应方程式的书写、多步反应计算、氧化还原反应的配平及有关方程式计算,注意利用关系式解答,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 有12 mol KI 被氧化 | B. | 转移11 mol电子 | ||
| C. | 生成CuI 382g | D. | I2只是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室要配制0.lmol/LNaOH溶液400mL,需称取NaOH 固体1.6g | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | Al2O3熔点很高,可用作耐火材料 | |
| D. | 纯锌和铁相连接后,插入同一稀盐酸中,锌极上发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{z}{12m}$ | B. | $\frac{12z}{m}$ | C. | $\frac{{N}_{A}}{m}$ | D. | $\frac{{N}_{A}}{z}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共只需一次过滤操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
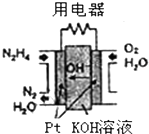 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com